题目内容
19.废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.(1)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是BD(填字母).
A.热裂解形成燃油
B.露天焚烧
C.作为有机复合建筑材料的原料
D.直接填埋
(2)已知下列热化学方程式:
O2(g)═O+2(g)+e-△H1=+1175.7kJ•mol-1
PtF6(g)+e-═PtF6-(g)△H2=-771.1kJ•mol-1
O2+PtF6-(s)═O2+(g)+PtF6-(g)△H3=+482.2kJ•mol-1
则反应O2(g)+PtF6(g)=O2+PtF6-(s)的△H=-77.6kJ/mol.
(3)25℃,1.01×105Pa时,16g液态甲醇(CH3OH)完全燃烧,当恢复到原状态时,放出热量363.3kJ,该反应的热化学方程式为CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.6 kJ•mol-1(相对原子质量 C-12 H-1 O-16 ),当此反应生成66g CO2时,放出的热量为1089.9KJ.
分析 (1)根据环境保护时不会产生污染环境的因素来判断;
(2)根据原子守恒写出另一种反应物;利用盖斯定律解答,从待求反应出发,分析待求反应中的反应物和生成物在已知反应中的位置,通过相互加减可得;
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,依据书写热化学方程式的方法写出该反应的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.6 kJ•mol-1.
解答 解:(1)因热裂解形成燃油及作为有机复合建筑材料的原料都可实现资源的再利用,露天焚烧能生成有害气体则污染空气,直接填埋则废旧印刷电路板中的重金属离子会污染土壤,所以不符合环境保护理念的是BD;
故答案为:BD;
(2)由原子守恒可知,另一种反应物为PtF6(g);
已知:①O2(g)=O2+(g)+e-△H1=+1175.7kJ•mol-1
②PtF6(g)+e-=PtF6-(g)△H2=-771.1kJ•mol-1
③O2PtF6(S)=O2+(g)+PtF6-(g)△H3=+482.2kJ•mol-1
据盖斯定律,①+②-③得:O2(g)+PtF6(g)=O2PtF6(s)△H=-77.6 kJ•mol-1,
故答案为:PtF6(g);-77.6 kJ•mol-1;
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,依据书写热化学方程式的方法写出该反应的热化学方程式为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.6 kJ•mol-1;66g CO2的物质的量是1.5mol,726.6KJ×1.5=1089.9KJ,
故答案为:CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H=-726.6 kJ•mol-1;1089.9KJ.
点评 本题考查了环境保护、盖斯定律的应用、反应热的计算等,题目难度中等,注意把握盖斯定律的含义,侧重于考查学生的分析能力和计算能力.

 阅读快车系列答案
阅读快车系列答案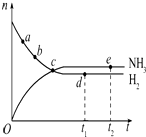 合成氨工业对国民经济和社会发展具有重要的意义,对于密闭容器中的反应:N2(g)+3H2(g) $\stackrel{一定条件}{?}$2NH3(g),在637K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
合成氨工业对国民经济和社会发展具有重要的意义,对于密闭容器中的反应:N2(g)+3H2(g) $\stackrel{一定条件}{?}$2NH3(g),在637K、30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | 其他条件不变,773 K下反应至t1时刻,n(H2)比图中d点的值大 |
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
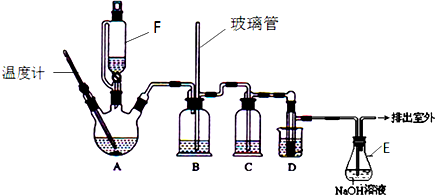
(1)A中主要发生的是乙醇的脱水反应,即消去反应,请你写出乙醇的这个消去反应的化学方程式:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.D中发生反应的化学方程式为:CH2=CH2+Br2→CH2BrCH2Br.
(2)安全瓶B可以防止倒吸,并可以检查实验进行时导管是否发生堵塞.请写出发生堵塞时瓶B中的现象.b中水面会下降,玻璃管中的水柱会上升,甚至溢出
(3)在装置C中应加入c,其目的是吸收反应中可能生成的酸性气体:(填正确选项前的字母)a.水 b.浓硫酸c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)容器E中NaOH溶液的作用是吸收挥发出来的溴,防止污染环境.
(5)若产物中有少量副产物乙醚.可用蒸馏(填操作名称)的方法除去.
(6)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发;但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使导管堵塞.
| A. | 大力实施矿物燃料的脱硫脱硝技术可以减少SO2、NOx的排放 | |
| B. | PM2.5是直径≤2.5微米的细颗粒物,其表面积大,易附带有毒有害物质 | |
| C. | O3能消毒杀菌,空气中O3浓度越大越有利于人体健康 | |
| D. | 汽车尾气中的CO主要来自汽油的不完全燃烧 |
(1)在实验前,依据Fe2+的还原性,填写了如表.
| 实验操作 | 预期现象 | 反应的离子方程式 |
| 向盛有新割FeSO4溶液的试管中滴入数滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液颜色逐渐变黄 | Fe2++NO3-+2H+=Fe3++NO2↑+H2O |
(2)分别取少量反应后的溶液于两只试管中,一只滴加几滴KSCN溶液,溶液变为变红,则溶液中含有Fe3+;另一只试管滴加几滴K3[Fe(CN)6]溶液,产生蓝色沉淀,则含有Fe2+.
(3)该小组讨论认为深棕色可能是NO2或NO与铁的某一种离子发生反应引起的.
提出猜想:
ⅰ.NO2与Fe2+发生反应ⅱ.NO2 与Fe3+发生反应
ⅲ.NO与Fe2+发生反应ⅳ.NO与Fe3+发生反应
(4)该小组用如图装置进行探究:
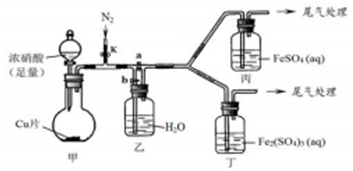
| 步骤 | 操作及现象 | 解释或结论 |
| ① | 关闭k、b,打开a,开始甲中反应,一段时间后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化 | 溶液深棕色由Fe2+与NO或NO2反应而的得到 |
| ② | 停止甲中反应,打开k、b,关闭a,持续通入N2一段时间 | 该操作的目的排净乙装置及导气管中的NO2 |
| ③ | 更换新的丙、丁装置,再通一段时间N2后关闭k,使甲中反应继续,观察到的现象与步骤①中相同 | 乙瓶中发生的化学反应方程式为3NO2+H2O=2HNO3+NO |
溶液呈深棕色的原因:肯定成立的是猜想ⅲ;不确定的是猜想i,有待后续实验进一步探究.
 (1)良好的生态环境可以提升生活质量.
(1)良好的生态环境可以提升生活质量. 分析图象回答:曲线②NO转化率随温度升高而增大的原因反应没有达到平衡,温度越高反应速率越快,转化率越大.在图2中画出反应2NO(g)+2CO(g)?N2(g)+2CO2(g)在不同温度下达到平衡时c(N2)的变化趋势图.
分析图象回答:曲线②NO转化率随温度升高而增大的原因反应没有达到平衡,温度越高反应速率越快,转化率越大.在图2中画出反应2NO(g)+2CO(g)?N2(g)+2CO2(g)在不同温度下达到平衡时c(N2)的变化趋势图.