题目内容
17.有混合气体x,它是由NO、H2、CO2组成,通入足量的Na2O2层后,变成混合气体y,将y用电火花引燃使其充分反应,只得到浓度为70%的HNO3溶液,无其他任何气体,则x中NO、H2、CO2的体积之比为( )| A. | 1:1:1 | B. | 1:2:7 | C. | 4:2:7 | D. | 2:4:7 |
分析 涉及的反应有2Na2O2+2CO2=2Na2CO3+O2,2H2+O2=2H2O,4NO+3O2+2H2O=4HNO3,得到浓度为70%的硝酸溶液,设硝酸为70g,则水为30g,则有n(HNO3)=$\frac{70g}{63g/mol}$=$\frac{10}{9}$mol,n(H2O)=$\frac{30g}{18g/mol}$=$\frac{15}{9}$mol,根据方程式结合质量守恒计算.
解答 解:涉及的反应有2Na2O2+2CO2=2Na2CO3+O2,2H2+O2=2H2O,4NO+3O2+2H2O=4HNO3,
得到浓度为70%的硝酸溶液,设硝酸为70g,则水为30g,则有n(HNO3)=$\frac{70g}{63g/mol}$=$\frac{10}{9}$mol,n(H2O)=$\frac{30g}{18g/mol}$=$\frac{15}{9}$mol,则
4NO+3O2 +2H2O=4HNO3
4 3 2 4
$\frac{10}{9}$mol n1(O2) n(H2O) $\frac{10}{9}$mol
所以n(NO)=$\frac{10}{9}$mol,
n(H2)=n(H2O)=$\frac{5}{9}$mol+$\frac{15}{9}$mol=$\frac{20}{9}$mol,
2H2 +O2 =2H2O
2 1 2
$\frac{20}{9}$mol$\frac{10}{9}$mol
n(O2)=$\frac{10}{9}$mol+$\frac{3}{4}$×$\frac{10}{9}$mol=$\frac{17.5}{9}$mol,
2Na2O2+2CO2=2Na2CO3+O2
2 1
n(CO2) $\frac{17.5}{9}$mol
n(CO2)=2×$\frac{17.5}{9}$mol=$\frac{35}{9}$mol,
则n(NO):n(H2):n(CO2)=$\frac{10}{9}$mol:$\frac{20}{9}$mol:$\frac{35}{9}$mol=2:4:7,
故选D.
点评 本题考查混合物的计算,题目难度较大,本题注意根据反应的化学方程式,从质量守恒的角度解答.

| A. | 只含一个双键的链状化合物 | B. | 含一个双键的环状化合物 | ||
| C. | 含一个三键的链状化合物 | D. | 含两个双键的链状化合物 |
| ⅠA | ⅧA | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑧ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
(1)元素④的名称是氧,从元素原子得失电子的角度看,元素④具有氧化性(填“氧化性”、“还原性”);
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性:H2O>H2S>PH3(写氢化物的化学式);
(3)元素③④⑤形成的离子半径由大到小的顺序是N3->O2->Na+(用离子符号表示)
(4)元素⑦的原子结构示意图是
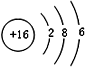 ;
;(5)最高价氧化物对应水化物酸性最强的酸是HClO4,化学性质最稳定的是Ne金属性最强的元素是Na(用化学符号表示)
| A. | N2O | B. | N2 | C. | NO | D. | NO2 |
| 编号 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径/10-10m | 0.77 | 0.99 | 1.86 | 0.75 | 1.17 | 1.02 | 1.43 | 0.71 | 1.52 | 0.89 |
| 最高正化合价 | +4 | +7 | +1 | +5 | +4 | +6 | +3 | +1 | +2 | |
| 最低负化合价 | -4 | -1 | -3 | -4 | -2 | -1 |
(1)②和⑧两元素所对应的氢化物,最稳定的是HF(填化学式);
(2)③和⑥两元素的最高价氧化物对应水化物的反应是放热(填“放热”或“吸热”)反应;
(3)①⑤⑦三种元素的最高价氧化物对应水化物,酸性由强到弱的顺序是H2CO3>H2SiO3>Al(OH)3(填化学式).
| A. | 灼热的炭与CO2反应 | B. | 铝片与稀H2SO4反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl的反应 | D. | 甲烷在O2中的燃烧反应 |
| A. | MgCl2 | B. | NH4Cl | C. | CO2 | D. | NaOH |
| A. | H2SO4 | B. | NaCl | C. | NaOH | D. | CH3COOH |