题目内容
6.25℃时,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则反应后溶液中溶质为NH4Cl 和NH3•H2O;用含a的代数式表示NH3•H2O的电离平衡常数Kb=$\frac{1{0}^{-9}}{a-0.01}$.分析 在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3•H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(O{H}^{-})c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$.
解答 解:反应平衡时溶液中c(NH4+)=c(Cl-),则溶质为NH4Cl 和NH3•H2O;
平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3•H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3•H2O的电离常数Kb=$\frac{c(O{H}^{-})c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{1{0}^{-7}×0.005}{0.5aa-0.005}$=$\frac{1{0}^{-9}}{a-0.01}$,
故答案为:NH4Cl 和NH3•H2O;$\frac{1{0}^{-9}}{a-0.01}$.
点评 本题考查了离子浓度大小比较、电离平衡常数计算,题目难度中等,明确溶液酸碱性,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.下列实验基本操作正确的是( )
| A. | 手持试管给试管里的物质加热 | |
| B. | 用天平称量药品时,用手直接取放砝码 | |
| C. | 用pH试纸测定溶液的酸碱性时,一定要先把试纸用蒸馏水润湿一下 | |
| D. | 两端有大、小两匙的药匙,取用很少量的氧化铜粉末时应用小匙 |
17.有混合气体x,它是由NO、H2、CO2组成,通入足量的Na2O2层后,变成混合气体y,将y用电火花引燃使其充分反应,只得到浓度为70%的HNO3溶液,无其他任何气体,则x中NO、H2、CO2的体积之比为( )
| A. | 1:1:1 | B. | 1:2:7 | C. | 4:2:7 | D. | 2:4:7 |
18.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 26g的苯和乙炔的混合物最多可以与2mol的氢气发生加成 | |
| B. | 某温度下,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×10-3NA | |
| C. | 标准状况下,NA个NO分子和0.5NA个O2分子充分反应后气体体积为22.4 L | |
| D. | 氢气与氯气反应生成标准状况下22.4 L氯化氢,断裂化学键总数为1NA |
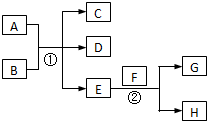 已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略去),请回答下列问题:
已知常温下E为无色无味的液体,F为淡黄色粉末,G为常见的无色气体(反应条件均已略去),请回答下列问题: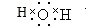 .
.
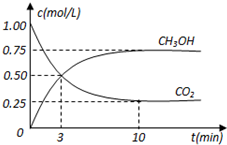 在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500oC下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示.
在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500oC下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H=-49.0kJ/mol测得CO2和CH3OH(g)的浓度随时间变化如图所示. ,该化合物中含有极性共价键(填“极性”或“非极性”).
,该化合物中含有极性共价键(填“极性”或“非极性”).