题目内容
18.海水开发利用的部分过程如图所示.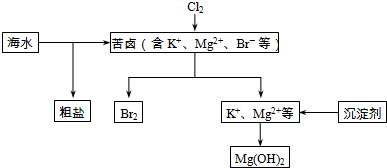
(1)向苦卤中通入Cl2是为了提取溴,发生反应的离子方程式为Cl2+2Br-=2Cl-+Br2.
(2)富集溴一般先用空气和水蒸气吹出单质溴,再用SO2的水溶液将其还原吸收,发生反应的化学方程式为SO2+Br2+2H2O=H2SO4+2HBr.也可用纯碱吸收溴,主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),吸收1mol Br2时,转移的电子为$\frac{5}{3}$mol.
(3)下列有关海水综合利用的说法错误的是BC.
A.粗盐可采用除杂和重结晶等过程提纯
B.电解饱和食盐水可制得金属钠
C.工业生产常选用NaOH作为沉淀剂
D.海水提镁涉及到复分解反应.
分析 海水开发利用:空气吹出法是用于工业规模海水提溴的常用方法,其中一种工艺是在预先经过酸化的浓缩海水中,用氯气置换溴离子使之成为单质溴,继而通入空气和水蒸气,将溴吹入吸收塔,使溴蒸汽和吸收剂二氧化硫发生作用转化成氢溴酸以达到富集的目的,也就是得到富集溴.然后,再用氯气将其氧化得到产品溴,粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时应加入试剂进行除杂,过滤后向滤液中加入盐酸至溶液呈中性,再进行重结晶进行提纯,镁形成氢氧化镁沉淀.
(1)向苦卤中通入Cl2置换出溴单质,分离得到溴;
(2)先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收转化为HBr,达到富集的目的,二氧化硫和溴单质反应生成溴化氢和硫酸,用纯碱吸收溴,主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3,配平书写化学方程式,结合元素化合价变化和电子转移守恒计算;
(3)A.粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时应加入试剂进行除杂,过滤后向滤液中加入盐酸至溶液呈中性,再进行重结晶进行提纯;
B.饱和食盐水电解,阳极是氯离子失电子生成氯气,阴极是氢离子得到电子生成氢气,溶液中生成氢氧化钠溶液;
C.工业生成处于生石灰或石灰水作沉淀剂;
D.海水提镁,涉及生成氢氧化镁、氢氧化镁与盐酸反应.
解答 解:(1)向苦卤中通入Cl2置换出溴单质,分离得到溴,通入Cl2是为了提取溴,分液的离子方程式为:Cl2+2Br-=2Cl-+Br2,故答案为:Cl2+2Br-=2Cl-+Br2;
(2)海水提取溴一般用氯气置换溴离子转化为溴单质,溴单质沸点低,易挥发,用空气和水蒸气吹出单质溴,再用SO2将其还原吸收转化为HBr,达到富集的目的,用SO2的水溶液将其还原吸收,发生反应的化学方程式为SO2+Br2+2H2O=H2SO4+2HBr,纯碱吸收溴单质,溴元素化合价0价变化为-1价和+5价,电子转移5e-,配平得到3Br2+6Na2CO3+3H2O→5NaBr+NaBrO3+6NaHCO3,反应中,Br元素化合价分别由0价变化为-1价、+5价,反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,2×n氧化剂(Br2)=2×5×n还原剂(Br2),故n氧化剂(Br2):n还原剂(Br2)=5:1,故吸收1mol Br2时,转移的电子数为1mol×2×$\frac{1}{1+5}$×5=$\frac{5}{3}$mol,
故答案为:$\frac{5}{3}$;
(3)A.粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时通常在溶液中依次中加入过量的BaCl2溶液、过量的NaOH溶液和过量的Na2CO3溶液,过滤后向滤液中加入盐酸至溶液呈中性,再进行重结晶进行提纯,故A正确;
B.电解饱和食盐水生成的是氯气、氢气和氢氧化钠,电解熔融氯化钠生成钠和氯气,故B错误;
C.氢氧化钠是强碱,具有强腐蚀性价格高,工业生产中常选用生石灰或石灰水作沉淀剂,故C错误;
D.海水提镁,涉及生成氢氧化镁、氢氧化镁与盐酸反应,生成氯化镁电解可生成镁,涉及复分解反应,故D正确.
故答案为:BC.
点评 本题考查海水资源的综合利用,主要是氯化钠提取、溴的制备过程分析,注意掌握中学常见的化学工业,侧重对化学与技术的考查,题目难度中等.

| A. | 乙酸溶液中c(CH3COOH)大于NaOH溶液中c(Na+) | |
| B. | 乙酸溶液中水的电离程度比NaOH溶液中的小 | |
| C. | 若两溶液混合后pH=7,则有:c(Na+)═c(CH3COOH)+c(CH3COO-) | |
| D. | 分别稀释10倍,两溶液的pH之和大于14 |
| A. | FeCl3易溶于水 | B. | 液态的FeCl3不导电 | ||
| C. | FeCl3常温下不易分解 | D. | FeCl3溶于水能电离,呈酸性 |
| A. | 按F、Cl、Br、I的顺序,卤素单质的熔沸点相应升高 | |
| B. | 烷烃随碳原子数目增加,熔沸点相应升高 | |
| C. | 冰的密度低于液态水的密度,冰会浮在水面上 | |
| D. | 按O、S、Se、Te的顺序,氧族元素的气态氢化物稳定性逐渐减弱 |
| 选项 | 物质 | 杂质 | 试剂 | 主要操作 |
| A | 乙炔 | H2S、PH3 | NaOH溶液 | 洗气 |
| B | 乙醛 | 乙酸 | Na2CO3溶液 | 分液 |
| C | 溴乙烷 | 溴单质 | NaHSO3溶液 | 分液 |
| D | CH3CH2OH | H2O | 熟石灰 | 蒸馏 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 过滤时,玻璃棒与三层滤纸的一边接触 | |
| B. | 过滤时,漏斗下端紧贴烧杯内壁 | |
| C. | 加热试管内物质时,试管底部与酒精灯灯芯接触 | |
| D. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 |

| A. | 氧化性:Cr3+>Fe3+ | |
| B. | 电池充电时,b极的电极反应式为Fe3++e-═Fe2+ | |
| C. | a、b电极材料均可以用碳棒或铜片 | |
| D. | 电池放电时,a极c(Cl-)增大 |