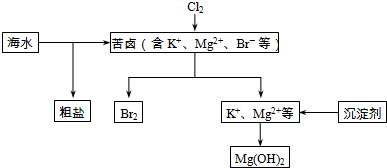
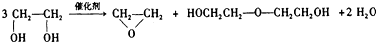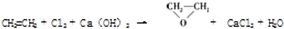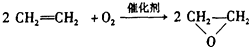题目内容
10.下列关于溶液的说法错误的有几个( )①NaHCO3溶液加水稀释,c(Na+)/c(HCO3-)的比值保持增大
②浓度均为0.1mol/L的Na2CO3、NaHCO3混合溶液:2c(Na+)=3[c(CO32-)+c(HCO3-)]
③在0.1mol/L氨水中滴加0.1 mol/L盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH-)=l0-amol/L
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大
⑤在Na2S稀溶液中,c(H+)=c(OH-)+c(H2S)+c(HS-)
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
分析 ①NaHCO3溶液加水稀释,溶液中钠离子的物质的量不变,而碳酸氢根离子的水解程度增大,据此判断c(Na+)/c(HCO3-)的比值变化;
②根据Na2CO3、NaHCO3混合溶液中的物料守恒判断;
③在0.1mol/L氨水中滴加0.1 mol/L盐酸,恰好完全中和时生成氯化铵,铵根离子水解促进了水的电离,则溶液中氢离子为水电离的;
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,氢氧根离子浓度增大,抑制了亚硫酸根离子的水解;
⑤根据Na2S稀溶液中的质子守恒判断.
解答 解:①NaHCO3溶液加水稀释,Na+的物质的量不变,而HCO3-的电离程度增大,物质的量减小,由于在同一溶液中,则c(Na+)/c(HCO3-)的比值保持增大,故①正确;
②浓度均为0.1mol/L的Na2CO3、NaHCO3混合溶液中,根据物料守恒可得:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)],故②错误;
③在0.1mol/L氨水中滴加0.1 mol/L盐酸,恰好完全中和时溶液的pH=a,氢离子浓度为l0-amol/L,反应后溶质为氯化铵,铵根离子水解促进了水的电离,溶液中的氢离子是水电离的,则由水电离产生的c(OH-)=c(H+)=l0-amol/L,故③正确;
④向0.1mol/LNa2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大
⑤在Na2S稀溶液中,根据质子守恒可得:c(H+)=c(OH-)+2c(H2S)+c(HS-),故⑤错误;
根据分析可知,错误的有2个,
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及盐的水解原理、酸碱混合的定性判断、离子浓度大小比较等知识,明确电荷守恒、物料守恒、质子守恒及盐的水解原理的含义为解答关键,试题培养了学生的分析能力及灵活应用能力.

 名校课堂系列答案
名校课堂系列答案| A. | 纤维素在人体内不能被消化吸收,可帮助消化 | |
| B. | 可以用Si3N4、Al2O3制作高温结构陶瓷制品 | |
| C. | 在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀 | |
| D. | 禁止使用四乙基铅作汽油抗爆震剂,可减少汽车尾气污染 |
| A. | Mg2+、Fe3+、Cl-、OH- | B. | Ba2+、HCO3-、Cl-、Na+ | ||
| C. | Fe2+、SO42-、H+、NO3- | D. | K+、NH4+、SO42-、OH- |
| A. | 用铁作电极电解饱和食盐水:Fe+2H2O$\frac{\underline{\;电解\;}}{\;}$Fe(OH)2+H2↑ | |
| B. | 偏铝酸钠溶液能使酚酞试液变红:AlO2-+2H2O?Al(OH)3+OH- | |
| C. | 苯酚钠溶液中通入 | |
| D. | AgOH沉淀溶于氨水:AgOH+2NH3•H2O═[Ag(NH3)2]++OH-+2H2O |
| A. | Al2O3是两性氧化物,既能与所有的酸反应,也能与所有的碱反应 | |
| B. | 铝制容器可盛装热的浓H2SO4 | |
| C. | 明矾[KAl(SO4)2•12H2O]的水溶液能够杀菌消毒,可用做净水剂 | |
| D. | 向AlCl3溶液中加入过量氨水后,蒸干并灼烧可得到Al2O3 |
| A. | NH3和O2反应 | B. | NH3和HNO3反应 | C. | NO和O2反应 | D. | NH3和水反应 |