题目内容
13.某学习小组利用废旧电池拆解后的碳包滤渣(含MnO2、C、Hg2+ 等)制取硫酸锰晶体( MnSO4•H2O ),实验流程如下: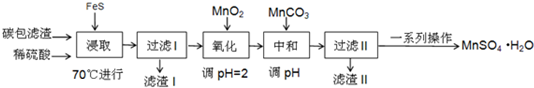
已知:(1)25℃时,几种硫化物的溶度积常数如下:
| 物质 | FeS | MnS | HgS |
| 溶度积 | 5×10-18 | 4.6×10-14 | 2×10-54 |
| Fe(OH)2 | Fe(OH)3 | Mn (OH)2 | |
| 开始沉淀时的PH | 6.3 | 2.7 | 8.3 |
| 沉淀完全时的PH | 8.4 | 3.7 | 9.8 |
(1)“浸取”时加热的作用是提高浸取的反应速率;
写出“浸取”时生成MnSO4、Fe2(SO4)3 反应的离子方程式:9MnO2+2FeS+20H+=9Mn2++2Fe3++2SO42-+10H2O.
(2)若“浸取”在25℃时进行,加入足量FeS,则FeS(s)+Hg2+(aq)?HgS(s)+Fe2+ (aq)的平衡常数K为2.5×1036.
(3)过滤I过程中,需要使用的玻璃仪器有烧杯、漏斗、玻璃棒,滤渣I的主要成分为FeS、S 和HgS和C(化学式).
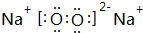
(4)“氧化”时加入MnO2 的作用是将Fe2+全部氧化为Fe3+,也可用H2O2 代替MnO2 ,H2O2 的电子式为
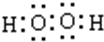 .
.(5)“中和”过程,应该调节溶液PH为3.7≤PH<8.3,写出该过程产生滤渣II的离子方程式:2Fe3++3MnCO3+3H2O=2Fe(OH)3+3Mn2++3CO2↑
(6)获得MnSO4•H2O的“一系列操作”是蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(7)1150℃时,MnSO4•H2O 在氩气氛围中进行焙烧的分解产物是Mn3O4、硫的氧化物等,分解反应的化学方程式是:3MnSO4•H2O$\frac{\underline{\;高温\;}}{\;}$Mn3O4+SO2↑+2SO3↑+3H20,在MnSO4•H2O进行焙烧时,除加热仪器外,还需要的仪器中主要成分属硅酸盐的有坩埚、泥三角.
分析 将碳包滤渣溶于稀硫酸中,二氧化锰和汞离子溶于稀硫酸,C不溶于稀硫酸,向溶液中加入FeS,根据表中数据知,FeS转化为HgS沉淀,然后过滤,得到的滤渣1中含有C、HgS且还有未反应的FeS,二氧化锰和FeS发生氧化还原反应9MnO2+2FeS+20H+=9Mn2++2Fe3++2SO42-+10H2O,则得到的滤液中含有硫酸锰、硫酸铁;
向滤液中加入二氧化锰,二氧化锰具有氧化性,酸性条件下能将Fe2+ 全部氧化为Fe3+,且不引入新杂质,然后向溶液中加入碳酸锰,调节溶液的pH值,将溶液中铁离子完全转化为氢氧化铁沉淀,而锰离子不反应,然后过滤得到的滤渣II为氢氧化铁,将滤液蒸发浓缩、冷却结晶得到MnSO4•H2O,
(1)升高温度,活化分子百分数增大,化学反应速率加快;浸取时反应生成MnSO4、Fe2(SO4)3,由此可判断出MnO2在酸性条件下氧化FeS,根据得失电子守恒配平反应,写出离子方程式;
(2)根据溶度积数据计算平衡常数,K=$\frac{c(F{e}^{2+})}{c(H{g}^{2+})}$=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(HgS)}$;
(3)过滤时,需要的玻璃仪器有烧杯、漏斗、玻璃棒;从硫化物的溶度积数据可以看出,加入FeS容易将Hg2+转化为HgS沉淀,C不溶于该溶液,且还有未反应的FeS;
(4)“氧化”过程,用MnO2将Fe2+ 全部氧化为Fe3+,加入H2O2也具有氧化性,且不引进杂质离子,双氧水分子中H、O原子之间共用一对电子,且O、O原子之间共用一对电子;
(5)将铁离子和锰离子分离,需要将铁离子转化为沉淀而锰离子不生成沉淀,根据表中生成沉淀所需pH值判断;
(6)从溶液中获得结晶水合物,要通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥一系列操作;
(7)根据反应物MnSO4•H2O在氩气氛围中进行焙烧的分解产物是Mn3O4、硫的氧化物等,依据化合价升降判断出生成物,并配平化学反应方程式;固体焙烧时需要的硅酸盐仪器有酒精灯、坩埚、泥三角.
解答 解:将碳包滤渣溶于稀硫酸中,二氧化锰和汞离子溶于稀硫酸,C不溶于稀硫酸,向溶液中加入FeS,根据表中数据知,FeS转化为HgS沉淀,然后过滤,得到的滤渣1中含有C、HgS且还有未反应的FeS,二氧化锰和FeS发生氧化还原反应9MnO2+2FeS+20H+=9Mn2++2Fe3++2SO42-+10H2O,则得到的滤液中含有硫酸锰、硫酸铁;
向滤液中加入二氧化锰,二氧化锰具有氧化性,酸性条件下能将Fe2+ 全部氧化为Fe3+,且不引入新杂质,然后向溶液中加入碳酸锰,调节溶液的pH值,将溶液中铁离子完全转化为氢氧化铁沉淀,而锰离子不反应,然后过滤得到的滤渣II为氢氧化铁,将滤液蒸发浓缩、冷却结晶得到MnSO4•H2O,
(1)用酸浸取固体,加入硫化亚铁作还原剂,温度低,反应慢,故加热提高浸取的反应速率;浸取时反应生成MnSO4、Fe2(SO4)3,由此可判断出MnO2在酸性条件下氧化FeS,根据得失电子守恒配平反应,写出离子方程式为9MnO2+2FeS+20H+=9Mn2++2Fe3++2SO42-+10H2O,
故答案为:提高浸取的反应速率;9MnO2+2FeS+20H+=9Mn2++2Fe3++2SO42-+10H2O;
(2)根据溶度积数据计算平衡常数,K=$\frac{c(F{e}^{2+})}{c(H{g}^{2+})}$=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(HgS)}$=$\frac{5×1{0}^{-18}}{2×1{0}^{-54}}$=2.5×1036,
故答案为:2.5×1036;
(3)过滤时,需要的玻璃仪器有烧杯、漏斗、玻璃棒;从硫化物的溶度积数据可以看出,加入FeS容易将Hg2+转化为HgS沉淀,C不溶于该溶液,所以滤渣1的成分为FeS、HgS和C,
故答案为:漏斗;玻璃棒;C和HgS;
(4)“氧化”过程,用MnO2将Fe2+ 全部氧化为Fe3+,加入H2O2也具有氧化性,且不引进杂质离子,双氧水分子中H、O原子之间共用一对电子,且O、O原子之间共用一对电子,电子式为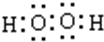 ,
,
故答案为:将Fe2+ 全部氧化为Fe3+;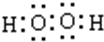 ;
;
(5)将铁离子和锰离子分离,需要将铁离子转化为沉淀而锰离子不生成沉淀,根据表中生成沉淀所需pH值知,调节溶液的pH为3.7≤PH<8.3,该过程产生滤渣II的离子方程式2Fe3++3MnCO3+3H2O=2Fe(OH)3+3Mn2++3CO2↑,
故答案为:3.7≤PH<8.3;2Fe3++3MnCO3+3H2O=2Fe(OH)3+3Mn2++3CO2↑;
(6)从溶液中获得结晶水合物,要通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥一系列操作,
故答案为:蒸发浓缩、冷却结晶;
(7)根据反应物MnSO4•H2O在氩气氛围中进行焙烧的分解产物是Mn3O4、硫的氧化物
等,依据化合价升降判断出生成物,并配平化学反应方程式为3MnSO4•H2O$\frac{\underline{\;高温\;}}{\;}$Mn3O4+SO2↑+2SO3↑+3H20;固体焙烧时需要的硅酸盐仪器有酒精灯、坩埚、泥三角,
故答案为:3MnSO4•H2O$\frac{\underline{\;高温\;}}{\;}$Mn3O4+SO2↑+2SO3↑+3H20;坩埚、泥三角.
点评 本题考查物质分离和提纯,为高频考点,侧重考查学生综合分析判断及知识综合运用能力,明确流程图中发生的反应、物质分离提纯方法、物质成分及其性质是解本题关键,综合性较强,注意结合表中的数据进行分析解答,难点是判断生成沉淀所需溶液的pH值.

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案| A. | NH4+和OH- | B. | HS-与S2- | C. | CO和N2 | D. | H2O2和K+ |
| A. | 9.3 | B. | 9.7 | C. | 10.3 | D. | 10.7 |
| X | ||||||
| Y | Z | W |
| A. | 工业上电解ZW3饱和溶液冶炼金属Z | |
| B. | 元素X的最高正价与W的最高正价相同 | |
| C. | 简单离子半径的大小顺序:r(X-)<r(Y+) | |
| D. | Y、W的最高价氧化物的水化物均能溶解金属Z |
| A. | 2﹕1 | B. | 1﹕2 | C. | 1﹕1 | D. | 1﹕4 |
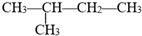 用系统命名法命名的名称是2-甲基丁烷,它的一氯代物有4种,若它是用烯烃和氢气加成而得到,则烯烃可能的结构简式是:CH2=(CH3)C-CH2-CH3;(CH3)2C=CH-CH3;(CH3)2CH-CH=CH2.
用系统命名法命名的名称是2-甲基丁烷,它的一氯代物有4种,若它是用烯烃和氢气加成而得到,则烯烃可能的结构简式是:CH2=(CH3)C-CH2-CH3;(CH3)2C=CH-CH3;(CH3)2CH-CH=CH2.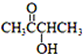 )有如下转化关系,且 1mol B反应生成了2mol C.
)有如下转化关系,且 1mol B反应生成了2mol C.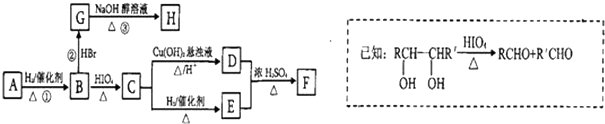
 .
.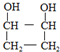 .
.
 .
.