题目内容
18.甲苯是有机化工的重要原料,可通过以下合成路线合成D.已知D能与NaHCO3反应产生CO2.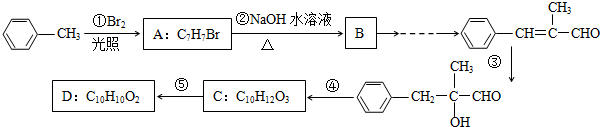
提示:a.R-X+NaOH→R-OH+NaX (-X表示卤原子)
b.

完成下列填空:
(1)C中官能团的名称为羟基、羧基;③的反应类型为加成反应.
(2)⑤的反应条件为浓硫酸,加热.
(3)①的化学方程式为
 .
.(4)设计合成路线,由B合成
 ,无机试剂任选,格式参照图.
,无机试剂任选,格式参照图. .
.
分析 根据题中各物质的转化关系,甲苯与溴在光照条件下发生取代反应生成A为 ,A碱性水解生成B为
,A碱性水解生成B为 ,B经过氧化生成苯甲醛,成苯甲醛与丙醛发生信息b中的反应可得
,B经过氧化生成苯甲醛,成苯甲醛与丙醛发生信息b中的反应可得 ,
, 与水加成得
与水加成得 ,
, 发生氧化反应得C为
发生氧化反应得C为 ,C发生消去反应D
,C发生消去反应D ,D能与碳酸氢钠反应生成二氧化碳,符合中物质的转化关系,据此答题.
,D能与碳酸氢钠反应生成二氧化碳,符合中物质的转化关系,据此答题.
解答 解:根据题中各物质的转化关系,甲苯与溴在光照条件下发生取代反应生成A为 ,A碱性水解生成B为
,A碱性水解生成B为 ,B经过氧化生成苯甲醛,成苯甲醛与丙醛发生信息b中的反应可得
,B经过氧化生成苯甲醛,成苯甲醛与丙醛发生信息b中的反应可得 ,
, 与水加成得
与水加成得 ,
, 发生氧化反应得C为
发生氧化反应得C为 ,C发生消去反应D
,C发生消去反应D ,D能与碳酸氢钠反应生成二氧化碳,符合中物质的转化关系,
,D能与碳酸氢钠反应生成二氧化碳,符合中物质的转化关系,
(1)C为 ,C中官能团的名称为 羟基、羧基,③的反应类型为加成反应,
,C中官能团的名称为 羟基、羧基,③的反应类型为加成反应,
故答案为:羟基、羧基;加成反应;
(2)反应⑤为醇的消去,所以⑤的反应条件为浓硫酸,加热,
故答案为:浓硫酸,加热;
(3)反应①为甲苯与溴在光照条件下发生取代反应生成 ,反应的化学方程式为
,反应的化学方程式为  ,
,
故答案为: ;
;
(4)B经过氧化生成苯甲醛,成苯甲醛与丙醛发生信息b中的反应可得 ,合成路线为
,合成路线为 ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,熟记有机物性质和反应条件并能灵活运用是解答本题的关键,再结合转化关系进行推断,需要学生熟悉掌握官能团的性质与演变,题目难度中等.

练习册系列答案
相关题目
8.X、Y、Z、W是原子序数依次增大的短周期主族元素,X原子的最外层电子数是其内层电子数的2倍,Y和W同主族,Z+与Y2-具有相同的电子层结构.下列说法正确的是( )
| A. | 原子半径:r(W)>r(Z)>r(Y)>r(X) | |
| B. | 元素Y分别与元素Z、W形成的化合物中化学键类型相同 | |
| C. | 元素Z和元素Y、W均能形成离子化合物 | |
| D. | 四种元素形成的氢化物中,沸点最高的是元素Y的氢化物 |
13.某种食用精制盐包装袋上有如表说明:
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)1KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体d.将分液漏斗充分振荡后静置
其中分液漏斗使用前须进行的操作是检查是否漏水,上述操作正确的顺序是:abdc(填序号)
(3)已知:I2+2S2O32-═2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol•L-1的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是1.0×10-5mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)$\frac{423}{w}$mg/kg.
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
| 分装时期 | |
| 分装企业 |
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳.
①Na2SO3稀溶液与I2反应的离子方程式是I2+SO32-+H2O=2I-+SO42-+2H+.
②某学生设计回收四氯化碳的操作为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体d.将分液漏斗充分振荡后静置
其中分液漏斗使用前须进行的操作是检查是否漏水,上述操作正确的顺序是:abdc(填序号)
(3)已知:I2+2S2O32-═2I-+S4O62-.某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol•L-1的Na2S2O3溶液10.0mL,恰好反应完全.
①判断c中反应恰好完全依据的现象是滴最后一滴溶液,由蓝色恰好变为无色,且半分钟内不变色.
②b中反应所产生的I2的物质的量是1.0×10-5mol.
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)$\frac{423}{w}$mg/kg.
3.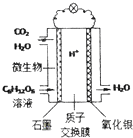 最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图.下列有关该电池的说法正确的是( )
最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图.下列有关该电池的说法正确的是( )
 最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图.下列有关该电池的说法正确的是( )
最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图.下列有关该电池的说法正确的是( )| A. | 氧化银电极上反应为:Ag2O+2e-═2Ag+O2- | |
| B. | 石墨电极上反应为:C6H12O6+6H2O+24e-═6CO2↑+24H+ | |
| C. | 每转移4mol电子,氧化银电极产生22.4LCO2气体(标准状况) | |
| D. | 每30g C6H12O6参与反应,有4mo1 H+经质子交换膜进入正极区 |
10.实验是研究化学的基础,图中所示的制备实验方法、装置或操作均正确的是( )
| A. | 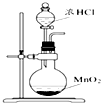 可用装置甲制取氯气 | |
| B. | 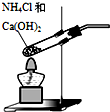 可用装置乙制取氨气 | |
| C. | 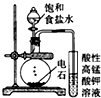 可用装置丙制取并检验乙炔(乙炔中含有H2S、PH3) | |
| D. | 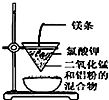 可用装置丁制得金属锰 |
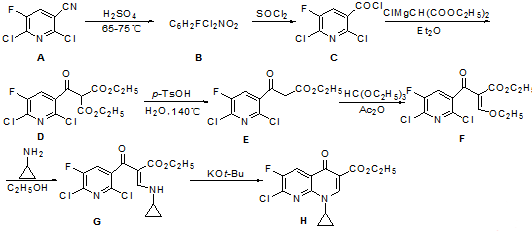
 .由C→D的反应类型是取代反应.
.由C→D的反应类型是取代反应. (其中一种).
(其中一种).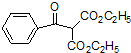 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: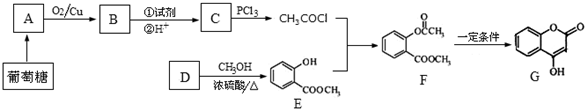
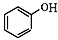 +NaOH→
+NaOH→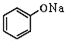 +H2O
+H2O .
. 、CH3COONa、CH3OH.
、CH3COONa、CH3OH.

 CH3COOCH2CH3+H2O,酯化(或取代)反应.
CH3COOCH2CH3+H2O,酯化(或取代)反应.