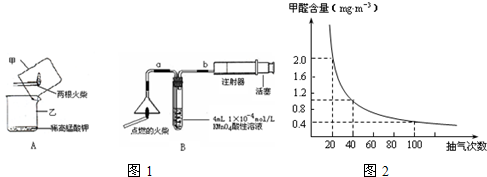
题目内容
短周期的四种元素X、Y、Z、W,原子系数依次增大,Z原子最外层电子数是X、Y、W三种原子的最外层电子数之和,Z与X、Y、W三种元素形成原子个数之比为1:1的化合物分别是A.B.C,其中化合物C在空气中容易变质,请回答:
(1)写出Z的原子结构示意图 .
(2)写出化合物YZ2电子式: 空间构形为: ,写出化合物C的电子式: 化学键类型有: .
(3)写出化合物C在空气中变质的化学方程式: .
(1)写出Z的原子结构示意图
(2)写出化合物YZ2电子式:
(3)写出化合物C在空气中变质的化学方程式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:Z原子最外层电子数是X、Y、W三种原子的最外层电子数之和,且Z与X、Y、W三种元素形成原子个数之比为1:1的化合物分别是A.B.C,则Z的最外层电子数≥4,属于非金属元素,若Z的最外层电子数4时,则为C或Si,X、Y只能为ⅠA族、W为ⅡA族元素,不满足条件;当Z的最外层电子数为5时,为ⅤA族元素,也不满足条件;当Z的最外层电子数为6时,为ⅥA族元素,可以为O元素,X为H元素、Y为C元素、W为Na元素,形成的A、B、C分别为过氧化氢、乙炔(或苯)、过氧化钠,符合条件,据此进行解答.
解答:
解:Z原子最外层电子数是X、Y、W三种原子的最外层电子数之和,且Z与X、Y、W三种元素形成原子个数之比为1:1的化合物分别是A、B、C,则Z的最外层电子数≥4,属于非金属元素,若Z的最外层电子数4时,则为C或Si,X、Y只能为ⅠA族、W为ⅡA族元素,不会形成满足条件的化合物;同样当Z的最外层电子数为5、7时,为ⅤA族、ⅤⅡ族元素,也不满足条件;而当Z的最外层电子数为6时,Z为ⅥA族元素,可以为O元素,X为H元素、Y为C元素、W为Na元素,形成的A、B、C分别为过氧化氢、乙炔(或苯)、过氧化钠,
(1)根据分析可知,Z为O元素,氧原子的原子结构示意图为: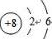 ,故答案为:
,故答案为: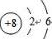 ;
;
(2)YZ2为CO2,二氧化碳为共价化合物,分子中存在两个碳氧双键,为直线型结构,其电子式为: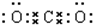 ;化合物C为过氧化钠,过氧化钠为离子化合物,其电子式为:
;化合物C为过氧化钠,过氧化钠为离子化合物,其电子式为: ,其化学式中存在离子键和共价键,
,其化学式中存在离子键和共价键,
故答案为: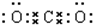 ;直线型;
;直线型; ;离子键和共价键;
;离子键和共价键;
(4)C为过氧化钠,过氧化钠能够与空气中的二氧化碳、氧气反应,反应的化学方程式为:2Na2O2+2CO2═2Na2CO3+O2、2Na2O2+2H2O═4NaOH+O2↑,
故答案为:2Na2O2+2CO2═2Na2CO3+O2、2Na2O2+2H2O═4NaOH+O2↑.
(1)根据分析可知,Z为O元素,氧原子的原子结构示意图为:
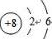 ,故答案为:
,故答案为: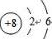 ;
;(2)YZ2为CO2,二氧化碳为共价化合物,分子中存在两个碳氧双键,为直线型结构,其电子式为:
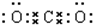 ;化合物C为过氧化钠,过氧化钠为离子化合物,其电子式为:
;化合物C为过氧化钠,过氧化钠为离子化合物,其电子式为: ,其化学式中存在离子键和共价键,
,其化学式中存在离子键和共价键,故答案为:
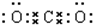 ;直线型;
;直线型; ;离子键和共价键;
;离子键和共价键;(4)C为过氧化钠,过氧化钠能够与空气中的二氧化碳、氧气反应,反应的化学方程式为:2Na2O2+2CO2═2Na2CO3+O2、2Na2O2+2H2O═4NaOH+O2↑,
故答案为:2Na2O2+2CO2═2Na2CO3+O2、2Na2O2+2H2O═4NaOH+O2↑.
点评:本题考查了位置、结构与性质关系的综合应用,题目难度中等,根据题干信息通过讨论推断出各元素名称为解答关键,注意掌握原子结构与元素周期表、元素周期表的关系,明确常见化学用语的概念及书写原则.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、常温常压下,48 g O3含有的氧原子数约为3NA |
| B、常温常压下,11.2 L乙烯(C2H4)含有2NA个碳原子 |
| C、1.7 g氨气所含有的电子数目为10 NA |
| D、2.7g铝与足量氢氧化钠溶液反应转移的电子数NA |
 现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E同主族,且D的氢化物常温时为液态.A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子.
现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E同主族,且D的氢化物常温时为液态.A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子.