题目内容
4.写出锌锰干电池的电极反应方程式,碱性锌锰干电池的总反应:2MnO2+Zn+2H2O═2MnO(OH)+Zn(OH)2
负极:Zn+2OH--2e-=Zn(OH)2 正极:MnO2+e-+H2O=MnOOH+OH-.
分析 该原电池中Zn元素化合价由0价变为+2价,则Zn作负极、二氧化锰作正极,负极上失电子发生氧化反应、正极上得电子发生还原反应,据此分析解答.
解答 解:该原电池中Zn元素化合价由0价变为+2价,则Zn作负极、二氧化锰作正极,负极上失电子发生氧化反应、正极上得电子发生还原反应,负极反应式为Zn+2OH--2e-=Zn(OH)2,正极反应式为MnO2+e-+H2O=MnOOH+OH-,
故答案为:Zn+2OH--2e-=Zn(OH)2;MnO2+e-+H2O=MnOOH+OH-.
点评 本题考查电极反应式的书写,为高频考点,也是学生学习难点,明确各个电极上发生的反应是解本题关键,注意结合电解质溶液酸碱性书写,题目难度中等.

练习册系列答案
相关题目
4.将a g二氧化锰粉末加入cL b mol•L-1的浓盐酸中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 可以收集到氯气$\frac{22.4b}{2{N}_{A}}$L | |
| B. | 反应后溶液中的Cl-数目为(bc•NA-2d) | |
| C. | NA可表示为$\frac{87d}{2a}$ | |
| D. | 反应后溶液中的H+数目为(bc-2d) |
12.下列有关工业生产叙述正确的是( )
| A. | 合成氨工业中,将NH3及时液化分离有利于提高产率 | |
| B. | 工业上通常使用电解法制备金属钠、镁、铝、铁等 | |
| C. | 硫酸工业中,采用常压条件的原因是此条件下催化剂活性最高 | |
| D. | 电解精炼铜时,将粗铜与电源的负极相连 |
9.某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.下列判断不正确的是( )
| A. | ClO-被还原 | |
| B. | 消耗1mol还原剂,转移3mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 反应后溶液的酸性明显增强 |
16.某物质的实验式为PtCl4•2NH3,其水溶液不导电,加入AgNO3溶液也不产生沉淀,以强碱处理也没有NH3放出,则关于此化合物的说法中正确的是( )
| A. | Cl-和NH3分子均为内界 | B. | 该配合物可能是平面正方形结构 | ||
| C. | 配合物中心Pt4+的配位数为4 | D. | 该配合物中有离子键 |
13.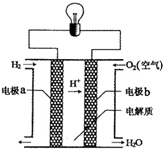 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法正确的是( )
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法正确的是( )| A. | 该电池工作时电能转化为化学能 | |
| B. | 该电池中电极b是负极 | |
| C. | 外电路中电子由电极b通过导线流向电极a | |
| D. | 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 |
14.下列原子或原子团,不属于官能团的是( )
| A. | OH- | B. | -NO2 | C. | -SO3H | D. | -Cl |
 .
.