题目内容
4. 已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.
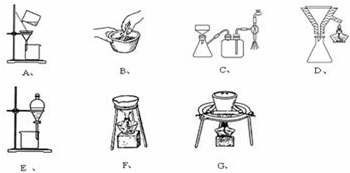
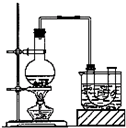
已知:CH3CH2OH+NaBr+H2SO4(浓)$\stackrel{△}{→}$ CH3CH2Br+NaHSO4+H2O.实验室制备溴乙烷(沸点为38.4℃)的装置和步骤如下:
①按如图所示连接仪器,检查装置的气密性,然后向U形管和大烧杯里加入冰水;②在圆底烧瓶中加入10mL95%乙醇、28mL浓硫酸,然后加入研细的13g溴化钠和几粒碎瓷片;③小火加热,使其充分反应.
试回答下列问题:
(1)反应时若温度过高可看到有红棕色气体产生,该气体的化学式为Br2.
(2)为了更好的控制反应温度,除用图示的小火加热,更好的加热方式是水浴加热.
(3)反应结束后,U形管中粗制的溴乙烷呈棕黄色.将U形管中的混合物倒入分液漏斗中,静置,待液体分层后,分液,取下层(填“上层”或“下层”)液体.为了除去其中的杂质,可选择下列试剂中的A(填序号).
A.Na2SO3溶液 B.H2O C.NaOH溶液 D.CCl4
(4)要进一步制得纯净的C2H5Br,可再用水洗,然后加入无水CaCl2干燥,再进行蒸馏(填操作名称).
(5)下列几项实验步骤,可用于检验溴乙烷中的溴元素,其正确的操作顺序是:取少量溴乙烷,然后④①⑤③②(填序号).
①加热 ②加入AgNO3溶液 ③加入稀HNO3酸化 ④加入NaOH溶液 ⑤冷却.
分析 本题利用醇能与HX酸反应的原理制备溴乙烷,涉及溴的物理性质是红棕色液体,易挥发,可通过水溶加热的方法控制反应温度,反应后的混合物因有机物与无机溶液不相溶而分层,下层为密度大于水的溴乙烷,通过分液分离后再进一步进行分离提纯;
(1)浓硫酸具有强氧化性,温度过高会把溴离子氧化成红棕色的溴;
(2)溴乙烷沸点为38.4℃,同时考虑到浓硫酸的强氧化性,为避免更多的副反应进行,只要控制温度略高于38.4℃即行,因此可以通过水浴进行加热就可以了;
(3)溴乙烷密度比水的密度大,分层后处于混合液的下层;分液后,溴乙烷中混有溴,除杂时注意溴和溴乙烷的性质角度考虑;
(4)溴乙烷沸点低,可以采用蒸馏方法分离;
(5)检验溴乙烷中溴元素,应在碱性条件下水解,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成;有溴乙烷参加的主要反应是溴乙烷和碱溶液中的水解.
解答 解:(1)由于浓硫酸具有强氧化性,能氧化Br-,会有溴生成,化学式为Br2,
故答案为:Br2;
(2)可以利用水浴加热来控制反应温度,
故答案为:水浴加热;
(3)由于溴乙烷密度大于水的密度,故溴乙烷应该在下层;粗制的C2H5Br呈棕黄色,说明含有单质溴杂质,则
A.Na2SO3与溴发生氧化还原反应,Na2SO3可除去溴,故A正确;
B.溴在溴乙烷中的溶解度比在水中大,加水难以除去溴乙烷中的溴,故B错误;
C.氢氧化钠溶液显示碱性,可以除去杂质溴,但溴乙烷也会在此溶液里发生水解反应,故C错误;
D.溴和溴乙烷都能溶于四氯化碳,不能将二者分离,故D错误;
故答案为:下层;A;
(4)溴乙烷的沸点是38.4℃,故采用蒸馏操作分离,故答案为:蒸馏;
(5)检验溴乙烷中溴元素,应在碱性条件下水解,最后加入硝酸酸化,加入硝酸银,观察是否有黄色沉淀生成,所以操作顺序为④①⑤③②,
故答案为:④①⑤③②.
点评 本题主要考查了溴乙烷的制备,掌握相关物质的基本化学性质,是解答本题的关键,平时须注意积累相关反应知识,本题难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | c(Mg2+)>c(Mn2+) | |
| B. | c(Mg2+)=c(Mn2+) | |
| C. | c(Mg2+)<c(Mn2+) | |
| D. | 沉淀类型不同,无法用Ksp比较二种离子的浓度 |
①粗盐和酸雨都是混合物;
②金属氧化物都是碱性氧化物;
③冰和干冰既是纯净物又是化合物;
④不锈钢和目前流通的硬币都是合金;
⑤盐酸和食醋既是化合物又是酸;
⑥纯碱和熟石灰都是碱;
⑦豆浆和雾都是胶体.
上述说法正确的是( )
| A. | ①②③④ | B. | ①②⑤⑥ | C. | ③⑤⑥⑦ | D. | ①③④⑦ |
| A. | 在丙烯醛分子中,仅含有一种官能团 | |
| B. | 丙烯醛能使溴水褪色,但不能使酸性高锰酸钾溶液褪色 | |
| C. | 丙烯醛能发生加聚反应,生成高聚物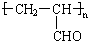 | |
| D. | 等物质的量的丙烯醛和丙醛完全燃烧,消耗等物质的量的O2 |
| A. | 硅可用于制光导纤维 | |
| B. | SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑中碳只做还原剂 | |
| C. | 因为玻璃中含有SiO2,所以不能用磨口玻璃塞的试剂瓶盛装碱性溶液 | |
| D. | SiO2能与氢氧化钠溶液和氢氟酸反应,所以SiO2是两性氧化物 |
| A. | 液态溴化氢 | B. | 液氨 | C. | 铝 | D. | 稀硝酸 |
| A. | 某烷烃命名为2,3,4-三甲基-3,5-二乙基己烷 | |
| B. | 结构片段为 的高聚物,是其单体通过缩聚反应生成 的高聚物,是其单体通过缩聚反应生成 | |
| C. | 所有的糖、油脂、蛋白质都能水解,但水解产物不同 | |
| D. | 醋酸和硬脂酸互为同系物,C2H6和C9H20也一定互为同系物 |