题目内容
5.能说明Cl的非金属性比S强的事实有( )①常温下S为固体,而Cl2为气体
②Cl2与H2混合,强光照射剧烈反应,而S与H2反应需较高温度
③与Fe反应,Cl2生成FeCl3,而S生成FeS
④盐酸是强酸,而氢硫酸是弱酸
⑤将Cl2通入氢硫酸中可置换出S.
| A. | ①③⑤ | B. | ②③⑤ | C. | ②③④ | D. | ②③④⑤ |
分析 比较非金属元素的非金属性强弱,可根据单质之间的置换反应、对应最高价氧化物的水化物的酸性、氢化物的稳定性等化学性质的角度判断,Cl的非金属性比S的非金属性强弱与物理性质无关.
解答 解:①常温时硫是固体,而氯气为气体,都是物理性质,与非金属性无关,所以无法说明非金属性的强弱,故错误;
②元素的非金属性越强,其单质与氢气化合越容易,Cl2与H2混合,强光照射剧烈反应,而S与H2反应需较高温度,氯气比S与氢气反应容易,则说明非金属性Cl>S,故正确;
③非金属单质与金属单质反应,生成产物的化合价越高,则非金属单质的氧化性越强,所以Cl2的氧化性大于S的氧化性,所以Cl的非金属性比S的强,故正确;
④比较元素的非金属性应用元素对应最高价氧化物的水化物的酸性强弱比较,不能根据氢化物的酸性强弱比较,例如盐酸的酸性比氢硫酸强,非金属性:Cl>S,但HF溶液的酸性比HCl弱,但非金属性:F>Cl,不能说明非金属性的强弱,故错误;
⑤将Cl2通入氢硫酸中可置换出S,说明氯气的氧化性比S强,单质的氧化性越强,非金属性越强,所以能证明Cl的非金属性比S的强,故正确;
则正确的有②③⑤;
故选B.
点评 本题考查非金属性的比较角度,题目难度不大,注意把握比较非金属性的方法,非金属性属于化学性质,与物理性质无关,非金属性强弱与失电子多少无关,题目难度不大.

练习册系列答案
相关题目
18.等质量的钠、镁、铝分别与足量的盐酸反应,产生H2的质量由大到小的排列顺序正确的是( )
| A. | Al、Mg、Na | B. | Mg、Al、Na | C. | Na、Mg、Al | D. | Na、Al、Mg |
19.一定温度和压强下,下列各可逆反应达到化学平衡状态,各反应有如图所示的对应关系:

(1)N2(g)+3H2(g)?2NH3(g)△H<0(曲线Ⅰ)
(2)H2(g)+I2(g)?2HI(g)△H>0(曲线Ⅱ)
(3)2SO3(g)?2SO2(g)+O2(g)△H>0(曲线Ⅲ)
则下列y轴的表达意义均符合上述三个平衡状态的是( )

(1)N2(g)+3H2(g)?2NH3(g)△H<0(曲线Ⅰ)
(2)H2(g)+I2(g)?2HI(g)△H>0(曲线Ⅱ)
(3)2SO3(g)?2SO2(g)+O2(g)△H>0(曲线Ⅲ)
则下列y轴的表达意义均符合上述三个平衡状态的是( )
| A. | 平衡混合气的平均相对分子质量 | |
| B. | 平衡混合气中一种反应物的浓度 | |
| C. | 平衡混合气中一种生成物的体积分数 | |
| D. | 平衡混合气中一种反应物的体积分数 |
16.设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A. | 标准状况下,11.2L苯中含有C-H键的数目为3NA | |
| B. | 常温下,1.0LPH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| C. | 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| D. | 电解饱和食盐水,阳极产生22.4L气体时,电路中通过的电子数目为2NA |
3.常温下,将CO2缓慢通入一定体积的NaOH溶液中,溶液的pH随通入CO2(标准状况)的变化曲线如图所示(忽略CO2的溶解),则下列说法中正确的是( )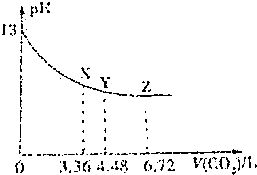

| A. | 该NaOH溶液的浓度为0.1mol/L,体积为6L | |
| B. | X、Y、Z三点对应的溶液中离子的种类不同 | |
| C. | Y点对应的融资中离子浓度关系为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) | |
| D. | Y点对应的溶液中存在着:c(Na+)=2c(HCO3-)+c(OH-) |
15.Mg(OH)2和MnCO3的Ksp数值相近,在Mg(OH)2和MnCO3两份饱和溶液中( )
| A. | c(Mg2+)>c(Mn2+) | |
| B. | c(Mg2+)=c(Mn2+) | |
| C. | c(Mg2+)<c(Mn2+) | |
| D. | 沉淀类型不同,无法用Ksp比较二种离子的浓度 |

 .
.