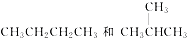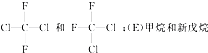题目内容
Fe2+转换成Fe3+的离子方程式为 .
考点:铁盐和亚铁盐的相互转变
专题:
分析:Fe2+具有还原性,能被强氧化剂氧化生成Fe3+,如氯气、硝酸、高锰酸钾等强氧化剂都可以将Fe2+氧化生成Fe3+,据此分析解答.
解答:
解:Fe2+具有还原性,能被强氧化剂氧化生成Fe3+,如氯气、硝酸、高锰酸钾等强氧化剂都可以将Fe2+氧化生成Fe3+,如:离子方程式为2Fe2++Cl2=2Fe3++2Cl-,故答案为:2Fe2++Cl2=2Fe3++2Cl-.
点评:本题考查铁离子、亚铁离子,熟练掌握铁元素及其化合物性质及其转化,知道铁离子、亚铁离子的检验方法、现象及操作步骤,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
胡椒酚是植物挥发油的成分之一,它的结构简式为 ,下列叙述中不 正确的是( )
,下列叙述中不 正确的是( )
 ,下列叙述中不 正确的是( )
,下列叙述中不 正确的是( )| A、胡椒酚在核磁共振中氢光谱有6个波峰 |
| B、胡椒酚与溴水中Br2按1:2反应,可以生成3种有机物 |
| C、胡椒酚可与甲醛发生反应,生成聚合物 |
| D、胡椒酚在水中的溶解度小于苯酚在水中的溶解度 |
今有HA、H2B两种弱酸,有如下关系:H2B+A-=HB-+HA,B2-+HA=HB-+A-,则下列说法正确的是( )
| A、H2B的电离方程式为:H2B?2H++B2- |
| B、结合质子能力由强到弱的顺序为:B2->A->HB-C |
| C、等物质的量浓度NaA、NaHB、Na2B三种盐的水溶液,NaA碱性最强 |
| D、等pH的HA、H2B两种溶液中,水的电离出的氢离子前者大于后者 |
 水是组成生命体的重要化学物质,有关水的反应有很多.
水是组成生命体的重要化学物质,有关水的反应有很多.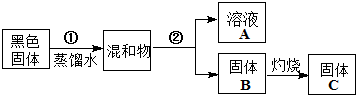
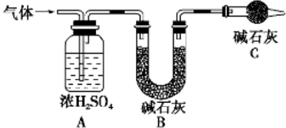 资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体并生成白色不溶物
资料显示:镁与饱和碳酸氢钠溶液反应产生大量气体并生成白色不溶物 某学生设计一套实验装置如图所示,通过实验除去混在氮气中的氧气、二氧化碳、硫化氢和乙烯等气体,制得干燥的氮气.
某学生设计一套实验装置如图所示,通过实验除去混在氮气中的氧气、二氧化碳、硫化氢和乙烯等气体,制得干燥的氮气.