题目内容
3.对于100mL 0.5mol/LH2SO4溶液与铁片的反应,采取下列措施能使反应速率加快的是:①升高温度;②改用100mL 1.0mol/LH2SO4溶液;③改用300mL 0.5mol/LH2SO4溶液;④用等量铁粉代替铁片;⑤改用质量分数为98%的H2SO4溶液( )| A. | ①③④ | B. | ①②④ | C. | ①②③④ | D. | ①②③⑤ |
分析 若要加快产生氢气的速率,可增大反应的浓度、增大固体的表面积、升高温度以及形成原电池反应,注意加入浓硫酸的性质,以此解答该题.
解答 解:①适当升高温度,增大活化分子百分数,反应速率加快,故正确;
②改用100mL 1.0mol/LH2SO4溶酸,酸的浓度增大,反应速率加快,故正确;
③改用300mL 0.5mol/LH2SO4溶液,酸的浓度不变,反应速率不变,故错误;
④用等量铁粉代替铁片,增大固体接触面积,使反应速率加快,故正确;
⑤改用98%的硫酸,浓硫酸与铁不生成氢气,则不能加快反应速率,故错误;
综上所述,①②④正确;
故选B.
点评 本题考查化学反应速率的影响因素,为高频考点,把握接触面积、温度、浓度等对反应速率的影响为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
8.同一周期X、Y、Z三种短周期元素,它们的气态氢化物的化学式分别为H2X、YH3、ZH4,下列说法不正确的是( )
| A. | 气态氢化物的稳定性:H2X<YH3<ZH4 | |
| B. | 最高价氧化物对应的水化物酸性:H2XO4>H3YO4>H2ZO3 | |
| C. | 元素的最高正化合价:X>Y>Z | |
| D. | 元素原子的半径:X<Y<Z |
15.将乙醇、浓硫酸和乙酸混合,加热一段时间,再加入少量H218O,充分反应.下列说法中正确的是( )
| A. | 18O只存在于乙酸分子中 | |
| B. | 18O存在于乙酸和乙酸乙酯中分子中 | |
| C. | 18O只存在于乙醇分子中 | |
| D. | 18O存在于水、乙酸分子中 |
13.下列用于解释事实的离子方程式书写正确的是( )
| A. | 铁粉溶于氯化铁溶液:Fe+2Fe3+=3Fe2+ | |
| B. | 硫化钠溶液呈碱性:S2-+2H2O?H2S+2OH- | |
| C. | 氯水具有漂白性:Cl2+H2O?2H++Cl-+ClO- | |
| D. | 工业上利用电解饱和食盐水制氯气:2H++2Cl-$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ |
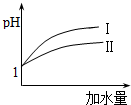 已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0.
已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0.
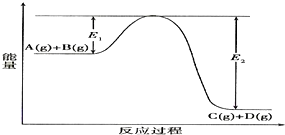

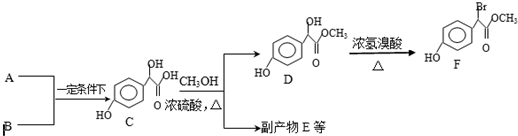
 .
.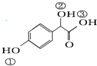 )中①、②、③3个-OH的酸性由强到弱的顺序是:③>①>②.
)中①、②、③3个-OH的酸性由强到弱的顺序是:③>①>②. 任意2种.
任意2种.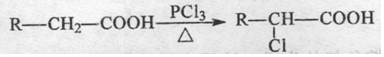 A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选).合成路线流程图示例如下:
A有多种合成方法,在方框中写出由乙酸合成A的路线流程图(其他原料任选).合成路线流程图示例如下: