题目内容
9.下列金属防腐的措施中,属于牺牲阳极的阴极保护法的是( )| A. | 水中的钢闸门连接电源的负极 | B. | 金属护拦表面涂漆 | ||
| C. | 汽水底盘喷涂高分子膜 | D. | 地下钢管连接锌板 |
分析 在原电池中,负极被腐蚀,正极被保护,此方法称为牺牲阳极的阴极保护法;在电解池中,阴极被保护,此方法称为外加电源的阴极保护法,据此分析.
解答 解:A、水中的钢闸门连接电源的负极,即做电解质的阴极,此方法为外加电源的阴极保护法,故A错误;
B、金属护栏表现涂漆是用油漆隔绝空气和水,没有形成原电池或电解池,故B错误;
C、汽车底盘喷涂高分子膜,没有形成原电池或电解池,故C错误;
D.地下钢管连接锌板,其中钢管和锌板构成原电池,钢管做正极被保护,锌板做负极被腐蚀,即为牺牲阳极的阴极保护法,故D正确.
故选D.
点评 本题考查了金属腐蚀的防护,应注意的是金属防护的方法有喷漆、牺牲阳极的阴极保护法和外加电源的阴极保护法等,掌握防护的原理是关键.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
20. 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可为C+CuO$\frac{\underline{\;高温\;}}{\;}$Cu+CO↑;
(2)把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)═CO2(g)△H1<0;①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)═CO(g)+H2(g)△H2>0;②
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g)△H3<0,③
2H2(g)+O2(g)═2H2O(g)△H4<0.④
则途径Ⅰ放出的热量等于(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量.
(3)甲醇是一种可再生能源,具有开发和应用的广阔前景,已知反应2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
比较此时正、逆反应速率的大小:v正>v逆(填“>”“<”或“=”).
(4)生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12 000~20 000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
则反应N2(g)+3F2(g)═2NF3(g)的△H=-291.9KJ•mol-1
(5)25℃、101kPa时,已知:
2H2O(g)═O2(g)+2H2(g)△H1
Cl2(g)+H2(g)═2HCl(g)△H2
2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是A
A.△H3=△H1+2△H2 B.△H3=△H1+△H2 C.△H3=△H1-2△H2 D.△H3=△H1-△H2
(6)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂.臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如6Ag(s)+O3(g)=3Ag2O(s)△H=-235.8kJ•mol-1,
已知:2Ag2O(s)=4Ag(s)+O2(g)△H=+62.2kJ•mol-1,
则O3转化为O2的热化学方程式为2O3(g)═3O2(g)△H=-285kJ/mol.
 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可为C+CuO$\frac{\underline{\;高温\;}}{\;}$Cu+CO↑;
(2)把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g)═CO2(g)△H1<0;①
途径Ⅱ:先制成水煤气:C(s)+H2O(g)═CO(g)+H2(g)△H2>0;②
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g)△H3<0,③
2H2(g)+O2(g)═2H2O(g)△H4<0.④
则途径Ⅰ放出的热量等于(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量.
(3)甲醇是一种可再生能源,具有开发和应用的广阔前景,已知反应2CH3OH(g)?CH3OCH3(g)+H2O(g)某温度下的平衡常数为400.此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/ (mol•L-1) | 0.44 | 0.6 | 0.6 |
(4)生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12 000~20 000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
| 化学键 | N≡N | F-F | N-F |
| 键能/kJ•mol-1 | 941.7 | 154.8 | 283.0 |
(5)25℃、101kPa时,已知:
2H2O(g)═O2(g)+2H2(g)△H1
Cl2(g)+H2(g)═2HCl(g)△H2
2Cl2(g)+2H2O(g)═4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是A
A.△H3=△H1+2△H2 B.△H3=△H1+△H2 C.△H3=△H1-2△H2 D.△H3=△H1-△H2
(6)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂.臭氧几乎可与除铂、金、铱、氟以外的所有单质反应.如6Ag(s)+O3(g)=3Ag2O(s)△H=-235.8kJ•mol-1,
已知:2Ag2O(s)=4Ag(s)+O2(g)△H=+62.2kJ•mol-1,
则O3转化为O2的热化学方程式为2O3(g)═3O2(g)△H=-285kJ/mol.
4.科学家发现,不管化学反应是一步完成还是分几步完成,该反应的热效应是相同的.已知在25℃,105 Pa时,1mol石墨和1mol一氧化碳完全燃烧生成二氧化碳时的放热分别是△H=-393.5kJ/mol和△H=-283kJ/mol,下列说法或方程式正确的是( )
| A. | 在相同条件下:2C(石墨,s)+O2(g)═2CO(g)△H=-110.5 kJ/mol | |
| B. | 1 mol石墨不完全燃烧,生成CO2和CO混合气体时,放热504.0 kJ | |
| C. | 在相同条件下,C(石墨,s)+CO2(g)═2CO(g)△H=+172.5 kJ/mol | |
| D. | 已知金刚石不如石墨稳定,则石墨转变为金刚石需要放热 |
14.一定温度下,向aL的密闭容器中加入2molNO2(g),发生如下反应:2NO2?2NO+O2,此反应达到平衡的标志是( )
| A. | 混合气体中NO2、NO和O2的物质的量之比为2:2:1 | |
| B. | 单位时间内生成2nmolNO同时生成2nmolNO2 | |
| C. | 单位时间内生成2nmolNO同时生成nmolO2 | |
| D. | 混合气体的颜色变浅 |
12.乙苯催化脱氢制苯乙烯反应:
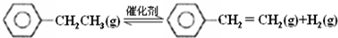
(1)已知:
计算上述反应的△H=+124 kJ•mol-1.
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{n{α}^{2}}{(1-{α}^{2})v}$(用α等符号表示).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.
图1是指:在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图.请回答:
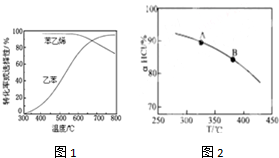
①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应方向气体分子数增加,加入水蒸气起稀释,相当于起减压的效果.
②控制反应温度为600℃的理由是600℃时,乙苯的转化率和苯乙烯的选择性均较高.温度过低,反应速率慢,转化率低;温度过高,选择性下降.高温还可能使催化剂失活,且能耗大
(4)乙苯催化脱氢制苯乙烯,另一产物氢气可用于工业制HCl.而O2将HCl转化为Cl2,2HCl(g)+$\frac{1}{2}$O2(g)?H2O(g)+Cl2(g)△H<0.新型RuO2催化剂对上述HCl转化为Cl2的反应具有更好的催化活性,图1是实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的αHCl-T曲线.
①A、B两点的平衡常数K(A)与K(B)中较大的是K(A).
②在上述实验中若压缩体积使压强增大,请在图2画出相应αHCl-T曲线的示意图.
③下列措施中有利于提高αHCl的有BD.
A、增大n(HCl) B、增大n(O2) C、使用更好的催化剂 D、移去H2O.

(1)已知:
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
(2)维持体系总压强p恒定,在温度T时,物质的量为n、体积为V的乙苯蒸汽发生催化脱氢反应.已知乙苯的平衡转化率为α,则在该温度下反应的平衡常数K=$\frac{n{α}^{2}}{(1-{α}^{2})v}$(用α等符号表示).
(3)工业上,通常在乙苯蒸气中掺混水蒸气(原料气中乙苯和水蒸气的物质的量之比为1:9),控制反应温度600℃,并保持体系总压为常压的条件下进行反应.
图1是指:在不同反应温度下,乙苯的平衡转化率和某催化剂作用下苯乙烯的选择性(指除了H2以外的产物中苯乙烯的物质的量分数)示意图.请回答:

①掺入水蒸气能提高乙苯的平衡转化率,解释说明该事实正反应方向气体分子数增加,加入水蒸气起稀释,相当于起减压的效果.
②控制反应温度为600℃的理由是600℃时,乙苯的转化率和苯乙烯的选择性均较高.温度过低,反应速率慢,转化率低;温度过高,选择性下降.高温还可能使催化剂失活,且能耗大
(4)乙苯催化脱氢制苯乙烯,另一产物氢气可用于工业制HCl.而O2将HCl转化为Cl2,2HCl(g)+$\frac{1}{2}$O2(g)?H2O(g)+Cl2(g)△H<0.新型RuO2催化剂对上述HCl转化为Cl2的反应具有更好的催化活性,图1是实验测得在一定压强下,总反应的HCl平衡转化率随温度变化的αHCl-T曲线.
①A、B两点的平衡常数K(A)与K(B)中较大的是K(A).
②在上述实验中若压缩体积使压强增大,请在图2画出相应αHCl-T曲线的示意图.
③下列措施中有利于提高αHCl的有BD.
A、增大n(HCl) B、增大n(O2) C、使用更好的催化剂 D、移去H2O.
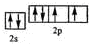 ,该元素的名称是氧;
,该元素的名称是氧;