题目内容
月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库.
(1)3He是高效能原料,其原子核内的中子数为
(2)Na的原子结构示意图为 ,Na在氧气中完全燃烧所得产物的电子式为
(3)MgCl2在工业上应用广泛,可由MgO制备.
①MgO的熔点比BaO的熔点 (填“高”或“低”)
②月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为 ;SiO2的晶体类型为 .
(1)3He是高效能原料,其原子核内的中子数为
(2)Na的原子结构示意图为
(3)MgCl2在工业上应用广泛,可由MgO制备.
①MgO的熔点比BaO的熔点
②月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为
考点:质量数与质子数、中子数之间的相互关系,电子式,原子结构示意图,离子方程式的书写,晶体熔沸点的比较
专题:原子组成与结构专题,化学键与晶体结构
分析:(1)根据中子数=质量数-质子数分析;
(2)Na的核外有11个电子,分三层排布;Na在氧气中燃烧生成过氧化钠,为离子化合物;
(3)①离子晶体的晶格能越大,熔点越高;
②MgO与强碱不反应,二氧化硅与强碱反应,根据二者性质的差别分析;原子间以共价键结合形成空间网状结构的晶体属于原子晶体.
(2)Na的核外有11个电子,分三层排布;Na在氧气中燃烧生成过氧化钠,为离子化合物;
(3)①离子晶体的晶格能越大,熔点越高;
②MgO与强碱不反应,二氧化硅与强碱反应,根据二者性质的差别分析;原子间以共价键结合形成空间网状结构的晶体属于原子晶体.
解答:
解:(1)3He中质量数为3,质子数为2,则中子数=3-2=1;故答案为:1;
(2)Na的核外有11个电子,分三层排布,分别为2、8、1,所以Na的原子结构示意图为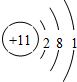 ;Na在氧气中燃烧生成过氧化钠,为离子化合物,其电子式为
;Na在氧气中燃烧生成过氧化钠,为离子化合物,其电子式为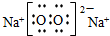 ;
;
故答案为: ;
;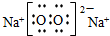 ;
;
(3)①离子晶体中离子半径越小,则离子键键能越大,其晶体的晶格能越大,熔点越高,已知镁离子半径小于钡离子半径,所以氧化镁的熔点高于氧化钡;
故答案为:高;
②MgO与强碱不反应,二氧化硅与强碱反应,向二者的混合物中加氢氧化钠溶液,可以除去二氧化硅,其反应的离子方程式:SiO2+2OH-=SiO32-+H2O;原子间以共价键结合形成空间网状结构的晶体属于原子晶体,二氧化硅属于原子晶体;
故答案为:SiO2+2OH-=SiO32-+H2O;原子晶体.
(2)Na的核外有11个电子,分三层排布,分别为2、8、1,所以Na的原子结构示意图为
 ;Na在氧气中燃烧生成过氧化钠,为离子化合物,其电子式为
;Na在氧气中燃烧生成过氧化钠,为离子化合物,其电子式为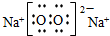 ;
;故答案为:
 ;
;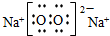 ;
;(3)①离子晶体中离子半径越小,则离子键键能越大,其晶体的晶格能越大,熔点越高,已知镁离子半径小于钡离子半径,所以氧化镁的熔点高于氧化钡;
故答案为:高;
②MgO与强碱不反应,二氧化硅与强碱反应,向二者的混合物中加氢氧化钠溶液,可以除去二氧化硅,其反应的离子方程式:SiO2+2OH-=SiO32-+H2O;原子间以共价键结合形成空间网状结构的晶体属于原子晶体,二氧化硅属于原子晶体;
故答案为:SiO2+2OH-=SiO32-+H2O;原子晶体.
点评:本题考查了原子结构、电子式、离子晶体熔沸点的比较等,考查的知识点较多,侧重于基础知识的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA |
| B、1 mol OH-在电解过程中完全放电时电路中通过了NA个电子 |
| C、铜的电解精炼时,阳极上每转移2mol电子时就溶解铜原子NA个 |
| D、1mol/L的Na2CO3溶液中CO32-粒子数目小于NA |
 室温下,向20mL a mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示.下列说法中,正确的是( )
室温下,向20mL a mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,其pH变化曲线如图所示.下列说法中,正确的是( )| A、a=1×10-3 |
| B、V(NaOH)=200amL时,溶液中:c (Na+)=c(CH3COO-)+c(CH3COOH)=0.1mol?L-1 |
| C、该滴定实验使用甲基橙作指示剂 |
| D、d点之后的溶液中离子浓度大小关系可能满足:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
 蒽与苯炔
蒽与苯炔 反应生成化合物X,X中的一个氢原子被甲基取代,所得取代产物的所有同分异构体数为( )
反应生成化合物X,X中的一个氢原子被甲基取代,所得取代产物的所有同分异构体数为( )| A、2种 | B、3种 | C、4种 | D、5种 |
 肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料.请回答下列问题:
肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料.请回答下列问题: