题目内容
20.14g铜、银合金与一定量某浓度的硝酸溶液反应,金属完全溶解,放出的气体与1.12L(标准状况下)氧气混合通入水中,恰好全部被水吸收,则合金中银的质量是( )| A. | 2.7g | B. | 5.4g | C. | 8.1g | D. | 10.8g |
分析 铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,纵观整个过程,金属提供的电子等于氧气获得的电子,根据二者质量与电子转移列方程计算.
解答 解:铜、银与硝酸反应生成硝酸铜、硝酸银与氮的氧化物,氮的氧化物与氧气、水反应生成硝酸,即:金属M$\stackrel{HNO_{3}}{→}$NOx$\stackrel{O_{2}}{→}$HNO3,整个反应过程中,硝酸相当于没有反应,金属提供的电子等于氧气获得的电子,
n(O2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,
设Cu、Ag的物质的量分别为x、y,
根据质量可得:x×64g/mol+y×108g/mol=14g
根据电子守恒可得:2x+1×y=0.05mol×4
解得:x=0.05mol;y=0.1mol,
所以合金中含有银的质量为:m(Ag)=0.1mol×108g/mol=10.8g,
故选D.
点评 本题考查化学方程式的有关计算,题目难度中等,根据始态终态法判断金属提供的电子等于氧气获得的电子是关键,注意掌握守恒思想的运用方法,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
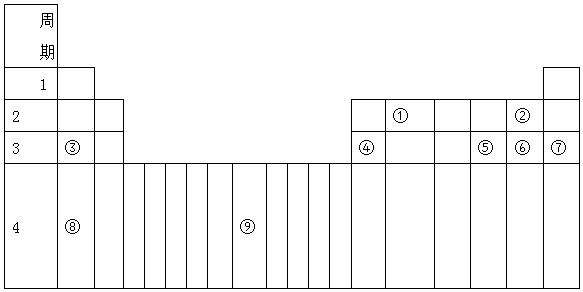
10. 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中W所处的周期序数是最外层电子数的一半.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中W所处的周期序数是最外层电子数的一半.下列判断不正确的是( )
 短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中W所处的周期序数是最外层电子数的一半.下列判断不正确的是( )
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中W所处的周期序数是最外层电子数的一半.下列判断不正确的是( )| A. | 最简单气态氢化物的热稳定性:R>Q | |
| B. | 最高价氧化物对应水化物的酸性:Q<W | |
| C. | 含T的盐溶液一定显酸性 | |
| D. | 实验室制备T的氢氧化物可以通过R形成的氢化物通入到T离子的溶液中得到 |
11.以下是表示反应2A+B=3C+4D的反应速率数据.按照反应快慢顺序排列应为( )
①υ(A)=0.5mol•L-1•S-1 ②υ(B)=0.3mol•L-1•S-1
③υ(C)=0.8mol•L-1•S-1 ④υ(D)=1mol•L-1•S-1.
①υ(A)=0.5mol•L-1•S-1 ②υ(B)=0.3mol•L-1•S-1
③υ(C)=0.8mol•L-1•S-1 ④υ(D)=1mol•L-1•S-1.
| A. | ④>③>①>② | B. | ②>③>①=④ | C. | ②>③>①>④ | D. | ③>②>①=④ |
8.化学与生产、生活、社会密切相关.下列有关说法中不正确的是( )
| A. | 2009年12月在哥本哈根召开的国际气候会议受到全球政要的广泛关注.减缓工业生产大量二氧化硫的排放以抑制全球气候变暖成为该会议的主题 | |
| B. | 针对目前甲型H1N1流感的扩散情况,要加强对环境、个人的消毒预防.其中消毒剂常选用含氯消毒剂、酒精、双氧水等适宜的物质 | |
| C. | 2009年诺贝尔物理学奖授予华裔科学家高锟,是因其在光纤材料领域取得了卓越贡献.光纤的主要成分与玛瑙相同,通常情况下不与强氧化剂和强酸反应 | |
| D. | 建国60周年庆典晚会上,天安门广场燃放的焰火是某些金属元素魅力的展现 |
5.下列说法正确的是( )
| A. | 28g N2含有的原子数为NA | |
| B. | 4gCa变成Ca2+失去的电子数为0.1NA | |
| C. | 1molO2的质量等于1mol O的质量 | |
| D. | 24gO2和24gO3所含有的原子数目相等 |
12.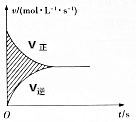 在容积为4L的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)?2Z(g)并达到平衡,在此过程中以Y的浓度改变表示的反应速率v正、v逆与时间t的关系如图所示,则图中阴影部分的面积表示( )
在容积为4L的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)?2Z(g)并达到平衡,在此过程中以Y的浓度改变表示的反应速率v正、v逆与时间t的关系如图所示,则图中阴影部分的面积表示( )
 在容积为4L的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)?2Z(g)并达到平衡,在此过程中以Y的浓度改变表示的反应速率v正、v逆与时间t的关系如图所示,则图中阴影部分的面积表示( )
在容积为4L的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)?2Z(g)并达到平衡,在此过程中以Y的浓度改变表示的反应速率v正、v逆与时间t的关系如图所示,则图中阴影部分的面积表示( )| A. | X的浓度的变化量 | B. | Y的浓度的减小量 | ||
| C. | Z的物质的量的变化量 | D. | Y的物质的量的减小量 |
19.若50滴水正好是m mL,则1滴水所含的分子数是( )
| A. | m×50×18×6.02×1023 | B. | $\frac{m×6.02×1{0}^{23}}{50×18}$ | ||
| C. | $\frac{18m×6.02×1{0}^{23}}{50}$ | D. | $\frac{50×18×m}{6.02×1{0}^{23}}$ |
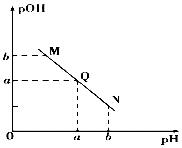 现有①0.1mol/L NaOH溶液和②0.1mol/L HX溶液.
现有①0.1mol/L NaOH溶液和②0.1mol/L HX溶液.