题目内容
7.下列离子方程式不 正确的是( )| A. | NH4HCO3与足量NaOH混合加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | NH3通入稀H2SO4中:NH3+H+═NH4+ | |
| C. | NaOH和NH4Cl稀溶液混合加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 氨水中加入稀盐酸:NH3•H2O+H+═NH4++H2O |
分析 A.氢氧化钠足量,碳酸氢根离子也参与反应;
B.氨气与硫酸反应生成硫酸铵;
C.加热条件下,氢氧化钠与氯化铵反应生成氯化钠、氨气和水;
D.一水合氨与氯化氢反应生成氯化铵和水.
解答 解:A.NH4HCO3与足量NaOH混合加热,反应生成碳酸钠、氨气和水,正确的离子方程式为:2OH-+NH4++HCO3-$\frac{\underline{\;\;△\;\;}}{\;}$CO32-+NH3↑+2H2O,故A错误;
B.NH3通入稀H2SO4中,反应的离子方程式为:NH3+H+═NH4+,故B正确;
C.NaOH和NH4Cl稀溶液混合加热生成氨气,反应的离子方程式为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,故C正确;
D.氨水中加入稀盐酸反应生成氯化铵,反应的离子方程式为:NH3•H2O+H+═NH4++H2O,故D正确;
故选A.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
13.下列所采取的分离方法正确的是( )
| A. | 由于碘在酒精中的溶解度大,所以可用酒精将碘水中的碘萃取出来 | |
| B. | 水的沸点是100℃,酒精的沸点是78.5℃,所以可用直接加热蒸馏法使含水酒精变为无水酒精 | |
| C. | 苯甲酸中含有少量氯化钠,可用重结晶的方法提纯得到苯甲酸 | |
| D. | 乙炔气体中混有少量硫化氢气体,可以通过足量溴水洗气除去 |
14.下列说法中错误的是( )
| A. | 符合通式CnH2n+2(n≥1)且相对分子质量不相等的有机物为同系物 | |
| B. | 符合同一通式且相对分子质量不相等的有机物为同系物 | |
| C. | 乙醇和甲醚不是同系物但是同分异构体 | |
| D. | CH3CH2CHO、CH2═CHCH2OH、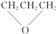 三种物质互为同分异构体 三种物质互为同分异构体 |
12.将氯气通入含有大量下列离子的各组溶液中,无现象发生的是( )
| A. | Na+ H+ SO42- | B. | H+ Ag+ NO3- | C. | K+ HCO3-Cl- | D. | Na+ NO3- Fe2+ |
19.在盛有足量A的体积可变的密闭容器中通入B,发生反应:A(s)+2B(g)?4C(g)+D(g)△H>0,在一定温度、压强下达到平衡.平衡时C的物质的量与通入B的物质的量的变化关系如图所示.下列说法正确的是:( )

| A. | 平衡时B的转化率为40% | |
| B. | 若再通入B,则再次达平衡时C的体积分数增大 | |
| C. | 在容器中加入催化剂,则B的转化率增大 | |
| D. | 若保持压强一定,当温度升高时,图中θ>45° |
16.下列有关能量的叙述不正确的是( )
| A. | 活化能的大小对化前后的能量变化不产生影响 | |
| B. | 化学键的断裂和形成是物质在化学变化中发生能量变化的主要原因 | |
| C. | 盐酸和NaOH(aq)反应的中和热△H=-57.3kJ.mol-1,则H2S04(aq)和Ba(0H)2(aq)反应的中 和热△H=2×(-57.3 )kJ•mol-1 | |
| D. | 因 N2(g)+3H2(g)?2NHs(g)△H=-dkJ.mol-1,故在某溶器中投入 l molN2与 3molH2充分反应后,放出热量小于dkJ |
17.下列反应的产物是纯净物的是( )
| A. | 乙烯和氯化氢组成 | B. | 乙醇和浓H2SO4共热 | ||
| C. | 乙炔加聚 | D. | CH4和Cl2光照 |