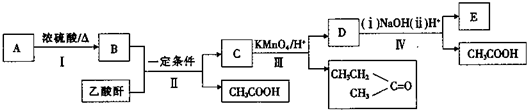
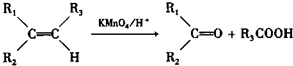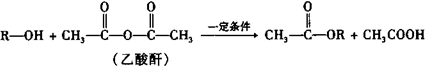题目内容
某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等.已知碳酸锰难溶于水.一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如图1:阴离子膜法电解装置如图2所示:
(1)写出用稀硫酸溶解碳酸锰反应的离子方程式 .
(2)已知不同金属离子生成氢氧化物沉淀所需的pH如表:
加氨水调节溶液的pH等于6,则滤渣的成分是 ,滤液中含有的阳离子有H+和 .
(3)在浸出液里锰元素只以Mn2+的形式存在,且滤渣中也无MnO2,请解释原因 .
(4)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的 极.实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为 .
(5)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式 .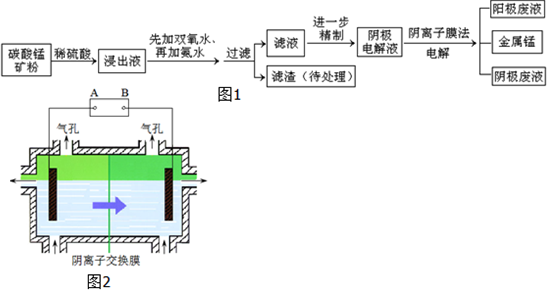
(1)写出用稀硫酸溶解碳酸锰反应的离子方程式
(2)已知不同金属离子生成氢氧化物沉淀所需的pH如表:
| 离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.3 |
| 沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
(3)在浸出液里锰元素只以Mn2+的形式存在,且滤渣中也无MnO2,请解释原因
(4)电解装置中箭头表示溶液中阴离子移动的方向,则A电极是直流电源的
(5)该工艺之所以采用阴离子交换膜,是为了防止Mn2+进入阳极区发生副反应生成MnO2造成资源浪费,写出该副反应的电极反应式

考点:物质分离和提纯的方法和基本操作综合应用,电解原理
专题:实验设计题
分析:将碳酸锰矿粉溶于稀硫酸中,MnCO3、FeCO3、MgO、Al2O3都和稀硫酸反应生成硫酸盐,酸性条件下,MnO2被亚铁离子还原生成Mn2+,SiO2以沉淀析出,然后向浸出液中先加双氧水、再加氨水,
并调节溶液的pH到6,根据氢氧化物沉淀需要的pH表知,pH=6时Fe3+、Al3+完全转化为沉淀,溶液中存在 Mn2+、Mg2+、NH4+,则滤渣为Al(OH)3、Fe(OH)3,然后进一步精制,再利用阴离子交换膜电解,
从而得到金属Mn,
(1)碳酸锰和稀硫酸反应生成硫酸锰、二氧化碳和水;
(2)根据氢氧化物沉淀需要的pH表知,pH=6时Fe3+、Al3+完全转化为沉淀,溶液中存在 Mn2+、Mg2+、NH4+;
(3)酸性条件下,MnO2被亚铁离子还原,亚铁离子被氧化生成Fe3+;
(4)电解时,电解溶液中阴离子向阳极移动,据此判断阴阳极,连接电解池阴极的电极是原电池负极;阳极上氢氧根离子放电生成氧气;
(5)锰离子不稳定,能被氧气氧化生成二氧化锰,据此书写电极反应式.
并调节溶液的pH到6,根据氢氧化物沉淀需要的pH表知,pH=6时Fe3+、Al3+完全转化为沉淀,溶液中存在 Mn2+、Mg2+、NH4+,则滤渣为Al(OH)3、Fe(OH)3,然后进一步精制,再利用阴离子交换膜电解,
从而得到金属Mn,
(1)碳酸锰和稀硫酸反应生成硫酸锰、二氧化碳和水;
(2)根据氢氧化物沉淀需要的pH表知,pH=6时Fe3+、Al3+完全转化为沉淀,溶液中存在 Mn2+、Mg2+、NH4+;
(3)酸性条件下,MnO2被亚铁离子还原,亚铁离子被氧化生成Fe3+;
(4)电解时,电解溶液中阴离子向阳极移动,据此判断阴阳极,连接电解池阴极的电极是原电池负极;阳极上氢氧根离子放电生成氧气;
(5)锰离子不稳定,能被氧气氧化生成二氧化锰,据此书写电极反应式.
解答:
解:将碳酸锰矿粉溶于稀硫酸中,MnCO3、FeCO3、MgO、Al2O3都和稀硫酸反应生成硫酸盐,酸性条件下,MnO2被亚铁离子还原生成Mn2+,SiO2以沉淀析出,然后向浸出液中先加双氧水、再加氨水,
并调节溶液的pH到6,根据氢氧化物沉淀需要的pH表知,pH=6时Fe3+、Al3+完全转化为沉淀,溶液中存在 Mn2+、Mg2+、NH4+,则滤渣为Al(OH)3、Fe(OH)3,然后进一步精制,再利用阴离子交换膜电解,
从而得到金属Mn,
(1)碳酸锰和稀硫酸反应生成硫酸锰、二氧化碳和水,离子方程式为MnCO3+2H+=Mn2++CO2↑+H2O,故答案为:MnCO3+2H+=Mn2++CO2↑+H2O;
(2)加入双氧水时将亚铁离子氧化为铁离子,根据氢氧化物沉淀需要的pH表知,pH=6时Fe3+、Al3+完全转化为沉淀,溶液中存在 Mn2+、Mg2+、NH4+,所以滤渣的成分是Al(OH)3、Fe(OH)3,滤液中含有的阳离子有H+和Mn2+、Mg2+、NH4+,故答案为:Al(OH)3、Fe(OH)3;Mn2+、Mg2+、NH4+;
(3)酸性条件下,MnO2被亚铁离子还原,亚铁离子被氧化生成Fe3+,所以在浸出液里锰元素只以Mn2+的形式存在,且滤渣中也无MnO2,故答案为:MnO2在酸性条件下被二价铁还原为Mn2+;
(4)根据阴离子移动方向知,左边电极是阴极、右边电极是阳极,则连接阴极的电极A是电源负极,阳极上氢氧根离子放电生成氧气,电极反应式为4OH--4e-=O2↑+2H2O,故答案为:负极;4OH--4e-=O2↑+2H2O;
(5)锰离子不稳定,易被氧气氧化生成二氧化锰,所以阳极反应的副反应为Mn2+-2e-+2H2O=MnO2+4H+,故答案为:Mn2+-2e-+2H2O=MnO2+4H+.
并调节溶液的pH到6,根据氢氧化物沉淀需要的pH表知,pH=6时Fe3+、Al3+完全转化为沉淀,溶液中存在 Mn2+、Mg2+、NH4+,则滤渣为Al(OH)3、Fe(OH)3,然后进一步精制,再利用阴离子交换膜电解,
从而得到金属Mn,
(1)碳酸锰和稀硫酸反应生成硫酸锰、二氧化碳和水,离子方程式为MnCO3+2H+=Mn2++CO2↑+H2O,故答案为:MnCO3+2H+=Mn2++CO2↑+H2O;
(2)加入双氧水时将亚铁离子氧化为铁离子,根据氢氧化物沉淀需要的pH表知,pH=6时Fe3+、Al3+完全转化为沉淀,溶液中存在 Mn2+、Mg2+、NH4+,所以滤渣的成分是Al(OH)3、Fe(OH)3,滤液中含有的阳离子有H+和Mn2+、Mg2+、NH4+,故答案为:Al(OH)3、Fe(OH)3;Mn2+、Mg2+、NH4+;
(3)酸性条件下,MnO2被亚铁离子还原,亚铁离子被氧化生成Fe3+,所以在浸出液里锰元素只以Mn2+的形式存在,且滤渣中也无MnO2,故答案为:MnO2在酸性条件下被二价铁还原为Mn2+;
(4)根据阴离子移动方向知,左边电极是阴极、右边电极是阳极,则连接阴极的电极A是电源负极,阳极上氢氧根离子放电生成氧气,电极反应式为4OH--4e-=O2↑+2H2O,故答案为:负极;4OH--4e-=O2↑+2H2O;
(5)锰离子不稳定,易被氧气氧化生成二氧化锰,所以阳极反应的副反应为Mn2+-2e-+2H2O=MnO2+4H+,故答案为:Mn2+-2e-+2H2O=MnO2+4H+.
点评:本题考查混合物的分离和提纯,侧重考查学生对知识的综合运用能力,涉及电解原理、氧化还原反应,知道流程图中各个步骤发生的反应、基本操作,题目难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
特大洪水过后,受灾地区的水源常被严重污染,下列物质中能用于被污染的饮用水消毒杀菌的是( )
| A、生石灰 | B、漂白粉 |
| C、明矾 | D、硫酸铁 |
向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色.淀粉KI溶液中通入SO2气体,溶液无明显变化.则下列分析中正确的是( )
| A、白色沉淀是CuI2,棕色溶液含有I2 |
| B、滴加KI溶液时,转移2mol e-时生成1mol白色沉淀 |
| C、通入SO2时,SO2与I-反应,I-作还原剂 |
| D、上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( )
| A、反应后溶液中不存在任何沉淀,所以反应前后Cu2的浓度不变 |
| B、沉淀溶解后,深蓝色的溶液为[Cu(NH3)4](OH)2 |
| C、在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子NH3提供空轨道 |
| D、用硝酸铜溶液代替硫酸铜溶液进行实验,能观察到同样的现象 |
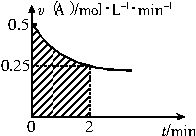 某溶液中发生反应A
某溶液中发生反应A| 无 |
| 无 |
| A、反应开始的前2min,A的平均反应速率小于0.375mol?L-1?min-1 |
| B、图中阴影部分的面积表示0~2min内A的物质的量浓度的减小值 |
| C、图中阴影部分的面积表示0~2min内A的物质的量的减小值 |
| D、至2min时,B的物质的量浓度c(B)介于1~1.5mol?L-1之间 |
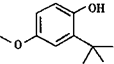
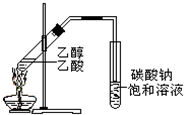 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: