题目内容
磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如图:
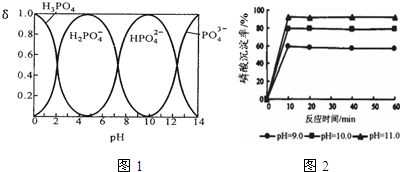
①从图1中推断NaH2PO4溶液呈 性(填“酸”、“碱”或“中”),这说明 .
②在Na3PO4溶液中,c(Na+)/c(PO43-) 3(填“>”“=”“<”);向该溶液中滴入几滴浓KOH溶液后,c(Na+)/c(PO43-)的值减小,原因是 .
③羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,有关反应为:5Ca(OH)2+3H3PO4=Ca5(PO4)3OH+9H2O.如图2是生产羟基磷灰石时得到的实验曲线,请计算磷酸的初始浓度为0.70mmol/L,pH=10.0条件下,反应前10min内磷酸的沉淀速率 .

①从图1中推断NaH2PO4溶液呈
②在Na3PO4溶液中,c(Na+)/c(PO43-)
③羟基磷灰石[Ca5(PO4)3OH]是一种重要的生物无机材料,有关反应为:5Ca(OH)2+3H3PO4=Ca5(PO4)3OH+9H2O.如图2是生产羟基磷灰石时得到的实验曲线,请计算磷酸的初始浓度为0.70mmol/L,pH=10.0条件下,反应前10min内磷酸的沉淀速率
考点:弱电解质在水溶液中的电离平衡
专题:
分析:①由图可知H2PO4-质量分数最大时溶液pH=5;
②在Na3PO4溶液中,PO43-水解;
③根据图可知pH=10.0条件下,磷的沉淀率为80%,根据v=
计算.
②在Na3PO4溶液中,PO43-水解;
③根据图可知pH=10.0条件下,磷的沉淀率为80%,根据v=
| △c |
| △t |
解答:
解:①由图可知H2PO4-质量分数最大时溶液pH=5,溶液呈酸性,说明H2PO4-在溶液中的电离程度大于水解程度,
故答案为:酸; H2PO4-在溶液中的电离程度大于水解程度;
②在Na3PO4溶液中,PO43-水解,则c(Na+)/c(PO43-)>3,向该溶液中滴入几滴浓KOH溶液后,KOH抑制了PO43-的水解,c(Na+)/c(PO43-)的值减小,
故答案为:>;KOH抑制了PO43-的水解;
③根据图可知pH=10.0条件下,磷的沉淀率为80%,磷的初始浓度为0.70mmol/L,则反应的量为0.70mmol/L×80%=0.56mmol/L,
则v=
=
=0.056mmol/(L?min);
故答案为:0.056mmol?L-1?min-1.
故答案为:酸; H2PO4-在溶液中的电离程度大于水解程度;
②在Na3PO4溶液中,PO43-水解,则c(Na+)/c(PO43-)>3,向该溶液中滴入几滴浓KOH溶液后,KOH抑制了PO43-的水解,c(Na+)/c(PO43-)的值减小,
故答案为:>;KOH抑制了PO43-的水解;
③根据图可知pH=10.0条件下,磷的沉淀率为80%,磷的初始浓度为0.70mmol/L,则反应的量为0.70mmol/L×80%=0.56mmol/L,
则v=
| △c |
| △t |
| 0.56mmol/L |
| 10min |
故答案为:0.056mmol?L-1?min-1.
点评:本题考查较为综合,涉及弱电解质的电离易盐类水解知识,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握表格数据及图象的分析利用,难度中等.

练习册系列答案
相关题目
下列有关实验原理或实验操作结论正确的是( )
| A、配制酸性KMnO4溶液时,用盐酸酸化 |
| B、用水湿润pH试纸测量某溶液的pH值 |
C、实验室用右图所示装置除去Cl2中的少量HCl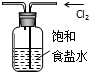 |
| D、用盐酸标准溶液滴定待测的氢氧化钠溶液时,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 |
洋蓟属高档蔬菜,从洋蓟提取的物质A具有良好的保健功能和药用价值,A在酸性条件下水解可生成B和C,反应可表示为下列说法不正确的是( )
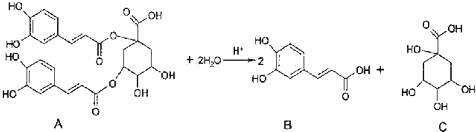

| A、A在一定条件下能发生取代反应、加成反应和消去反应 |
| B、1mol A和足量NaOH溶液反应,最多消耗11molNaOH |
| C、B能和浓溴水发生反应,1mol B最多消耗4 molBr2 |
| D、C分子中含有手性碳原子 |
常温下,下列各组粒子在指定体系中一定能大量共存的是( )
| A、遇苯酚变紫色的溶液:Na+、Mg2+、SO42-、H2O2 |
| B、0.1 mol?L-1 (NH4)2Fe(SO4)2溶液中:K+、Cu2+、Cl-、Fe3+ |
| C、使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Cl- |
| D、0.1mol?L-1 NaHCO3溶液:K+、AlO2-、Cl-、NO3- |
一定温度下,下列溶液的离子浓度关系式正确的是( )
| A、pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ | ||
| B、pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5 mol?L-1 | ||
| C、pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | ||
D、pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合:c(Na+)+c(H+)=c(OH-)+c(HC2O
|
下列有关平衡常数叙述中,正确的是( )
| A、不同浓度的同一弱电解质,其电离常数(K)不同 |
| B、温度越高,化学平衡常数一定越大 |
| C、平衡常数发生变化,化学平衡必定发生移动,达到新的平衡 |
| D、化学平衡发生移动,平衡常数必发生变化 |
化学是一门以实验为基础的学科,化学实验是化学学习的重要内容.根据你掌握的知识判断,下列实验操作的描述中,正确的是 ( )
| A、从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶 |
| B、用稀盐酸洗涤盛放过石灰水的试剂瓶 |
| C、配制H2SO4溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
| D、各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘纸上称量 |
| E、Na2CO3溶液不能保存在带有玻璃塞的试剂瓶中 |
| F、将用水润湿的pH试纸浸入稀盐酸中,测定溶液的pH. |