题目内容
| 物质 | 电离常数(25℃) |
| H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
| HCN | K=6.2×10-10 |
| HF | K=6.8×10-4 |
(1)写出碳酸的第一级电离平衡常数表达式:K1=
(2)①往Na2CO3溶液中加入足量HF溶液,发生反应的离子方程式:
②往NaCN溶液中通入少量CO2,发生反应的离子方程式:
Ⅱ.用电解法制取金属镁时,需要无水氯化镁.在干燥的HCl气流中加热MgCl2?6H2O时,能得到无水MgCl2,其原因是
考点:弱电解质在水溶液中的电离平衡,盐类水解的原理
专题:
分析:Ⅰ.(1)碳酸的第一级电离生成HCO3-和H+,结合电离平衡常数定义解答;
(2)①HF酸性比碳酸强,可与碳酸钠反应生成二氧化碳气体;
②HCN酸性大于HCO3-,往NaCN溶液中通入少量CO2,可生成HCO3-;
Ⅱ.根据氯化镁易水解的性质判断.
(2)①HF酸性比碳酸强,可与碳酸钠反应生成二氧化碳气体;
②HCN酸性大于HCO3-,往NaCN溶液中通入少量CO2,可生成HCO3-;
Ⅱ.根据氯化镁易水解的性质判断.
解答:
解:I.(1)碳酸的第一级电离生成HCO3-和H+,电离方程式为H2CO3?HCO3-+H+,电离常数为K=
,故答案为:
;
(2)①HF酸性比碳酸强,可与碳酸钠反应生成二氧化碳气体,离子方程式为2HF+CO32-=2F-+H2O+CO2↑,故答案为:2HF+CO32-=2F-+H2O+CO2↑;
②HCN酸性大于HCO3-,往NaCN溶液中通入少量CO2,可生成HCO3-,离子方程式为CN-+H2O+CO2=HCN+HCO3-,故答案为:CN-+H2O+CO2=HCN+HCO3-;
II.氯化镁易水解,制备无水氯化镁时,可在干燥的HCl气流中,抑制了MgCl2的水解,且带走了MgCl2?6H2O受热产生的水蒸气,
故答案为:在干燥的HCl气流中,抑制了MgCl2的水解,且带走了MgCl2?6H2O受热产生的水蒸气.
| c(HCO3-)?c(H+) |
| c(H2CO3) |
| c(HCO3-)?c(H+) |
| c(H2CO3) |
(2)①HF酸性比碳酸强,可与碳酸钠反应生成二氧化碳气体,离子方程式为2HF+CO32-=2F-+H2O+CO2↑,故答案为:2HF+CO32-=2F-+H2O+CO2↑;
②HCN酸性大于HCO3-,往NaCN溶液中通入少量CO2,可生成HCO3-,离子方程式为CN-+H2O+CO2=HCN+HCO3-,故答案为:CN-+H2O+CO2=HCN+HCO3-;
II.氯化镁易水解,制备无水氯化镁时,可在干燥的HCl气流中,抑制了MgCl2的水解,且带走了MgCl2?6H2O受热产生的水蒸气,
故答案为:在干燥的HCl气流中,抑制了MgCl2的水解,且带走了MgCl2?6H2O受热产生的水蒸气.
点评:本题考查较为综合,涉及弱电解质的电离以及盐类的水解,为高频考点,侧重于学生的分析能力和计算能力的考查,注意相关基础知识的积累,难度不大.

练习册系列答案
相关题目
一定温度下可逆反应:A(s)+2B(g)?2C(g)+D(g);△H>0.现将1molA和2molB加入甲容器中,将4molC和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动).下列说法正确的是( )


| A、保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的度的2倍 |
| B、保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 |
| C、保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 |
| D、保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
已知4NH3+5O2═4NO+6H2O,同一反应速率若分别用v(NH3)、v(O2)、v(H2O)、v(NO)(mol?L-1?min-1)来表示,则正确关系是( )
A、
| ||
B、
| ||
C、
| ||
D、
|
下列有关实验原理、方法和结论都正确的是( )
| A、向相同浓度的NaBr、NaI溶液中滴加硝酸银溶液,先出现黄色沉淀,说明KSP (AgI)>KSP (AgBr) |
| B、在3mL苯酚溶液中滴入几滴溴水,没有沉淀生成,说明苯酚没有和溴水反应 |
| C、向某有机物中加入氢氧化钠溶液、加热,然后向其中加入硝酸银溶液,发现产生了白色沉淀,说明该有机物中含有氯元素 |
| D、室温下向苯和少量苯酚的混合溶液中加入适量NaOH溶液,振荡、静置后分液,可除去苯中少量苯酚 |
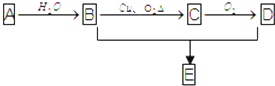
 如图所示是实验进行石油蒸馏的装置,请回答下列问题
如图所示是实验进行石油蒸馏的装置,请回答下列问题