题目内容
2. 如图为A物质的溶解度曲线.M、N两点分别表示A物质的两种溶液.下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水,步骤中的过滤操作均未写出)( )
如图为A物质的溶解度曲线.M、N两点分别表示A物质的两种溶液.下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水,步骤中的过滤操作均未写出)( )| A. | 从N→M:先向N中加入适量固体A再降温 | |
| B. | 从N→M:先将N降温再加入适量固体A | |
| C. | 从M→N:先将M降温再将其升温 | |
| D. | 从M→N:先将M升温再将其蒸发掉部分水 |
分析 溶解度曲线上的点和曲线上方的点表示的是该温度下的饱和溶液,溶解度曲线下方的点表示该温度下的不饱和溶液.M点是这一温度下的饱和溶液,N点是这一温度下的不饱和溶液,据此分析.
解答 解:A.从N→M意思是单位溶剂溶解溶质的量增加,溶液由不饱和变饱和且溶液温度降低,可采取增加溶质和降低温度的方法,故A正确;
B.从N→M意思是单位溶剂溶解溶质的量增加,溶液由不饱和变饱和且溶液温度降低,可采取增加溶质和降低温度的方法,故B正确;
C.从M→N:先将M降温再将其升温,降温时有晶体析出,但是题目没有说将晶体分离,之后如果升温到原温度,则溶液依旧饱和,所以此说法不一定能够实现,故C错误;
D.先将M升温溶质质量不会变小,此时溶液变为不饱和溶液,但然后将其蒸发掉部分水则溶液有可能又会变成饱和溶液,不能从M变化为N,故D错误.
故选CD.
点评 本题考查了溶解度曲线,题目难度不大,溶解度曲线上的点和曲线上方的点表示的是该温度下的饱和溶液,溶解度曲线下方的点表示该温度下的不饱和溶液.

练习册系列答案
相关题目
13.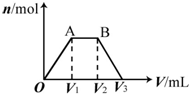 有KOH和Ca(OH)2的混合溶液,pH=13.取此溶液500mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示.图中(V1)为112mL(标准状况),则图中V2、V3的体积(单位为mL)分别是( )
有KOH和Ca(OH)2的混合溶液,pH=13.取此溶液500mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示.图中(V1)为112mL(标准状况),则图中V2、V3的体积(单位为mL)分别是( )
 有KOH和Ca(OH)2的混合溶液,pH=13.取此溶液500mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示.图中(V1)为112mL(标准状况),则图中V2、V3的体积(单位为mL)分别是( )
有KOH和Ca(OH)2的混合溶液,pH=13.取此溶液500mL,向其中通入CO2,通入CO2的体积(V)和生成沉淀的物质的量(n)的关系如图所示.图中(V1)为112mL(标准状况),则图中V2、V3的体积(单位为mL)分别是( )| A. | 560、672 | B. | 1008、1120 | C. | 2240、2352 | D. | 392、504 |
14.下列实验方案能达到相应实验目的是( )
| 选项 | 实验目的 | 方案 |
| A | 除去乙酸乙酯中的乙酸 | 用NaOH溶液洗涤,分液,然后干燥 |
| B | 除去葡萄糖溶液中的乙醇 | 用KMnO4氧化,再蒸馏 |
| C | 检验食盐中是否添加KIO3 | 食盐溶解,然后加入淀粉溶液 |
| D | 测定醋酸溶液浓度 | 酚酞作指示剂,用标准NaOH溶液滴定 |
| A. | A | B. | B | C. | C | D. | D |
11.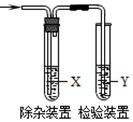 用如图所示装置检验乙烯时不需要除杂的是( )
用如图所示装置检验乙烯时不需要除杂的是( )
 用如图所示装置检验乙烯时不需要除杂的是( )
用如图所示装置检验乙烯时不需要除杂的是( )| 乙烯的制备 | 试剂X | 试剂Y | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | 水 | KMnO4酸性溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | 水 | Br2的CCl4溶液 |
| C | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
| A. | A | B. | B | C. | C | D. | D |
18.下列离子在溶液中能大量共存的是( )
| A. | Mg2+、K+、Cl-、AlO2- | B. | Al3+、Na+、NO3-、HCO3- | ||
| C. | NH4+、Fe3+、SO42-、NO3- | D. | Ca2+、H+、NO3-、S2O32- |
7.浓差电池中的电动势是由于电池中存在浓度差而产生的.某浓度差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法不正确的是( )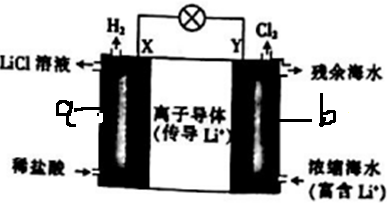

| A. | 电池工作时,Li+通过离子导体移向b区 | |
| B. | 电流由X极通过电路移向Y极 | |
| C. | 正极发生的反应为2H++2e-═H2↑ | |
| D. | Y极每生成1molCl2,a区得到2molLiCl |
14.图为实验室制取少量乙酸乙酯的装置图.下列关于该实验的叙述中,不正确的是( )


| A. | 向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 | |
| B. | 试管b中导气管下端管口不能浸入液面的原因是防止实验过程中发生倒吸现象 | |
| C. | 实验时加热试管a的目的是及时将乙酸乙酯蒸出并加快反应速率 | |
| D. | 试管b中Na2CO3的作用是除去随乙酸乙酯蒸出的少量乙酸和乙醇,降低乙酸乙酯在溶液中的溶解度 |
