题目内容
12.(1)氢氧燃料电池以KOH溶液作电解质溶液时,工作一段时间后,电解质溶液的浓度将变小,溶液的pH变小(选填“变小”、“增大”或“不变”).(2)氢氧燃料电池以H2SO4溶液作电解质溶液时,工作一段时间后,电解质溶液的浓度将变小,溶液的pH增大.
分析 氢氧燃料电池以KOH或H2SO4溶液作电解质溶液时,电池总反应与氢气在氧气中燃烧的化学方程式一致,产物为水,电解质溶液浓度变小.
解答 解:(1)在燃料电池中,通入燃料氢气的一极为电池的负极,在KOH溶液为电解质溶液时,负极反应为:2H2-4e-+4OH-=4H2O,正极反应为:O2+2H2O+4e-=4OH-,电池总反应即氢气在氧气中燃烧生成水:2H2+O2=2H2O,电池工作一段时间后,生成水使溶液体积增大,氢氧化钠溶液浓度变小,c(OH-)减小,PH值变小,
故答案为:变小;变小;
(2)电解质是酸性环境时,负极反应为:2H2-4e-=4H+,正极反应式为:O2+4H++4e-=2H2O,总反应为2H2+O2=2H2O,电池工作一段时间后,生成水使溶液体积增大,则硫酸的浓度变小,溶液PH值增大,
故答案为:变小;增大.
点评 本题考查了原电池工作原理,明确电池总反应是解题的关键,注意掌握电解质溶液不同时电极反应式书写,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2. 如图为A物质的溶解度曲线.M、N两点分别表示A物质的两种溶液.下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水,步骤中的过滤操作均未写出)( )
如图为A物质的溶解度曲线.M、N两点分别表示A物质的两种溶液.下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水,步骤中的过滤操作均未写出)( )
 如图为A物质的溶解度曲线.M、N两点分别表示A物质的两种溶液.下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水,步骤中的过滤操作均未写出)( )
如图为A物质的溶解度曲线.M、N两点分别表示A物质的两种溶液.下列做法不能实现M、N间的相互转化的是(A从溶液中析出时不带结晶水,步骤中的过滤操作均未写出)( )| A. | 从N→M:先向N中加入适量固体A再降温 | |
| B. | 从N→M:先将N降温再加入适量固体A | |
| C. | 从M→N:先将M降温再将其升温 | |
| D. | 从M→N:先将M升温再将其蒸发掉部分水 |
3.X、Y、Z、W 均为短周期元素,原子序数依次增大.Y 原子的 M 电子层有 1 个 电子,同周期的简单离子的半径中 Z 最小.W 与 X 同主族,其最高化合价是最低 负化合价绝对值的 3 倍.下列说法正确的是( )
| A. | 最高价氧化物水化物的碱性:Y<Z | B. | 简单气态氢化物的热稳定性:X<W | ||
| C. | 简单气态氢化物的沸点:X<W | D. | 简单离子的还原性:X<W |
20.下列说法正确的是( )
| A. | 用酸性KMnO4溶液能鉴别CH3CH═CHCH2OH和CH3CH2CH2CHO | |
| B. | 乙酸乙酯能水解,可用于制备肥皂 | |
| C. | 根据核磁共振氢谱不能鉴别1-溴丙烷和2-溴丙烷 | |
| D. | 食用花生油和鸡蛋清都能发生水解反应 |
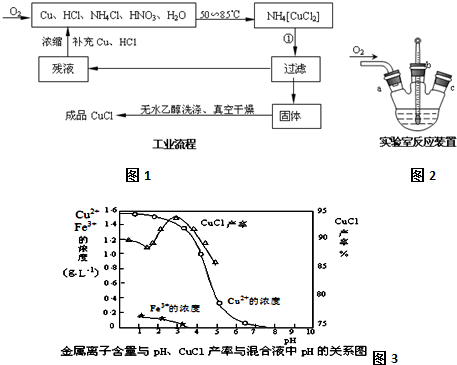
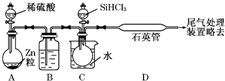 晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下: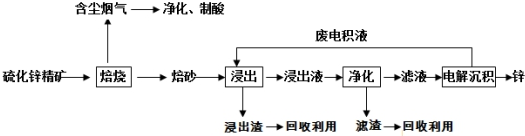
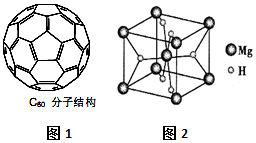 氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.
氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等. D.相同压强时,NH3沸点比PH3高
D.相同压强时,NH3沸点比PH3高