题目内容
19.硫酸的工业制备是一个重要的化工生产过程,但在生产过程中会产生大量污染,需要在生产工艺中考虑到绿色工艺.以硫酸工业产生的二氧化硫尾气、氨水、石灰石、焦炭、碳酸氢铵为原料可以合成硫化钙、硫酸铵、亚硫酸铵等物质.合成路线如下:
(1)写出反应Ⅰ的化学方程式2CaCO3+O2+2SO2=2CaSO4+2CO2.
(2)反应Ⅲ中每生成lmol硫化钙理论上转移电子数8NA;为充分利用副产品CO,有人提出以熔融的K2C03为电解质,设计燃料电池,请写出此电池的负极反应CO+CO32--2e-=2CO2.
(3)为检验反应Ⅱ得到的产品是否因部分被氧化而变质,需选择的化学试剂有稀盐酸、BaCl2溶液.
(4)根据合成流程,可以循环利用的是CaCO3.
(5)(NH4)2SO3溶液可用于电厂产生的烟道气的脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的离子方程式2NO2+4SO32-=N2+4SO42-.
分析 由流程可知,I中发生2CaCO3+O2+2SO2=2CaSO4+2CO2,反应Ⅳ为NH4HCO3、CaSO4、NH3反应生成碳酸钙和硫酸铵,发生NH4HCO3+NH3+CaSO4=CaCO3↓+(NH4)2SO4,可知碳酸钙可循环使用,Ⅱ中发生SO2+2NH3.H2O=(NH4)2SO3+H2O,Ⅲ中发生CaSO4+4C=CaS+4CO↑,以此来解答.
解答 解:(1)反应Ⅰ的化学方程式为2CaCO3+O2+2SO2=2CaSO4+2CO2,故答案为:2CaCO3+O2+2SO2=2CaSO4+2CO2;
(2)Ⅲ中发生CaSO4+4C=CaS+4CO↑,每生成lmol硫化钙理论上转移电子数1mol×[6-(-2)]×NA=8NA;充分利用副产品CO,有人提出以熔融的K2C03为电解质,设计燃料电池,此电池的负极反应为CO+CO32--2e-=2CO2,
故答案为:8NA;CO+CO32--2e-=2CO2;
(3)检验反应Ⅱ得到的产品是否因部分被氧化而变质,即检验硫酸根离子,则选择试剂为稀盐酸、BaCl2溶液,先加盐酸排除亚硫酸根离子干扰,再加氯化钡观察是否生成沉淀,故答案为:稀盐酸、BaCl2溶液;
(4)由反应Ⅰ、Ⅳ可知,循环使用的物质为CaCO3,故答案为:CaCO3;
(5)二氧化氮与亚硫酸铵反应的离子方程式为2NO2+4SO32-=N2+4SO42-,故答案为:2NO2+4SO32-=N2+4SO42-.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握发生的反应、物质的性质、离子检验及原电池、氧化还原反应等为解答的关键,侧重分析与应用能力的考查,题目难度中等.

练习册系列答案
相关题目
7.如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是( )
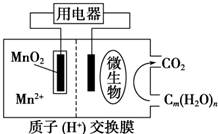

| A. | 正极反应式为MnO2+4H++2e-═Mn2++2H2O | |
| B. | 微生物所在电极区放电时发生还原反应 | |
| C. | 放电过程中,H+从正极区移向负极区 | |
| D. | 若用该电池给铅蓄电池充电,MnO2 电极质量减少8.7g,则铅蓄电池阴极增重9.6g |
14.化学在工农业生产和日常生活中都有重要应用.下列叙述正确的是( )
| A. | 葡萄糖和蛋白质等高分子化合物是人体必需的营养物质 | |
| B. | 酸雨是指pH<7.0的雨水 | |
| C. | 居室中放置一盆石灰水可以吸收CO,预防中毒 | |
| D. | 用二氧化碳生产聚碳酸酯可以减少碳排放,以减缓温室效应 |
4.如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.下列有关说法正确的是( )


| A. | 反应一段时间后,乙装置中生成的氢氧化钠在铁极区 | |
| B. | 乙装置中铁电极为阴极,电极反应式为Fe-2e -=Fe2+ | |
| C. | 通入氧气的一极为正极,发生的电极反应为O2-4e -+2H2O═4OH- | |
| D. | 反应一段时间后,丙装置中硫酸铜溶液浓度保持不变 |
 2013年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.
2013年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.
