题目内容
16.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 30g乙烷中所含的极性共价键数为7NA | |
| B. | 标准状况下,22.4LN2和CO2混合气体所含的分子数为2NA | |
| C. | 1L浓度为1mol•L-1的H2O2水溶液中含有的氧原子数为2NA | |
| D. | MnO2和浓盐酸反应生成1mol氯气时,转移电子数为2NA |
分析 A、求出乙烷的物质的量,然后根据乙烷中含6条极性共价键来分析;
B、分子数N=$\frac{V}{{V}_{m}}$NA;
C、在双氧水溶液中,除了双氧水外,水也含氧原子;
D、二氧化锰和盐酸反应时,氯元素的价态由-1价变为0价.
解答 解:A、30g乙烷的物质的量为1mol,而乙烷中含6条极性共价键,故1mol乙烷中含极性共价键6NA条,故A错误;
B、分子数N=$\frac{V}{{V}_{m}}$NA=$\frac{22.4L}{22.4L/mol}$NA=NA ,故B错误;
C、在双氧水溶液中,除了双氧水外,水也含氧原子,故溶液中含有的氧原子的个数大于2NA个,故C错误;
D、二氧化锰和盐酸反应时,氯元素的价态由-1价变为0价,故当生成1mol氯气时,转移2NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
7.日常所用锌-锰干电池的电极分别为锌筒和石墨棒,以糊状NH4Cl作电解质,电极反应为:Zn-2e-=Zn2+,2MnO2+2NH4++2e-=Mn2O3+2NH3+H2O.有关锌-锰干电池的叙述中,正确的是( )
| A. | 锌-锰干电池中锌筒为正极,石墨棒为负极 | |
| B. | 锌-锰干电池即使不用,放置过久,也会失效 | |
| C. | 锌-锰干电池工作时,电流方向是由锌筒经外电路流向石墨棒 | |
| D. | 锌-锰干电池可实现化学能向电能和电能向化学能的相互转化 |
4.一种气态烷烃和一种气态烯烃组成的混合物共10g,混合气体的密度是相同状况下H2密度的12.5倍.该混合气体通过装有溴水的试剂瓶时,试剂瓶的质量增加了8.4g,该混合气体可能是( )
| A. | 乙烷和乙烯 | B. | 乙烷和乙烯 | C. | 甲烷和乙烯 | D. | 甲烷和丙烯 |
11.四种短周期元素X、Y、Z、W的原子序数依次增大,依据表中信息判断,下列说法正确的是( )
| 元素 | X | Y | Z | W |
| 相关信息 | 元素周期表中核电荷数最小的元素 | 大气中含量最多的元素,其某些氧化物为大气中常见的污染物 | 地壳中含量最多的金属元素 | 原子最外层电子数是电子层数的二倍 |
| A. | X、Y、W三种元素不可能形成离子化合物 | |
| B. | Z的简单离子半径比Y的简单离子半径大 | |
| C. | 工业上常常通过电解Z的熔融氯化物的方法来获得Z的单质 | |
| D. | W的单质在氧气中燃烧火焰呈蓝紫色 |
8.化学与生活是紧密相连的,下列说法正确的是( )
| A. | 食用油脂饱和程度越大,熔点越高 | |
| B. | 海水淡化能解决淡水供应危机,向海水中加净水剂明矾可以使海水淡化 | |
| C. | 铁在潮湿的空气中放置,易发生化学腐蚀而生锈 | |
| D. | 用含有橙色的酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的氧化性 |


 CH3COOCH2CH3+H2O,用饱和碳酸钠溶液(填药品名称) 收集粗产品,用分液(填操作名称)的方法把粗产品分离.
CH3COOCH2CH3+H2O,用饱和碳酸钠溶液(填药品名称) 收集粗产品,用分液(填操作名称)的方法把粗产品分离.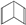 (Ⅰ)和
(Ⅰ)和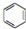 (Ⅱ)
(Ⅱ)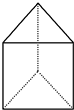
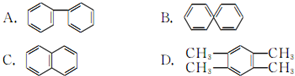

 .
. .
. 乙$\stackrel{NaHCO_{3}}{→}$丙(C13H9O2Na)
乙$\stackrel{NaHCO_{3}}{→}$丙(C13H9O2Na) .
.