题目内容
用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的是( )
A、 制备并收集乙炔 |
B、 除去乙醇中溶有的少量乙酸 |
C、 制备少量乙酸乙酯 |
D、 石油的分馏 |
考点:化学实验方案的评价
专题:
分析:A.乙炔的密度比空气的密度小;
B.乙酸、乙醇互溶,不分层;
C.乙酸与乙醇发生酯化反应生成乙酸乙酯,碳酸钠可除杂,降低乙酸乙酯的溶解度;
D.冷水的方向应下进上出.
B.乙酸、乙醇互溶,不分层;
C.乙酸与乙醇发生酯化反应生成乙酸乙酯,碳酸钠可除杂,降低乙酸乙酯的溶解度;
D.冷水的方向应下进上出.
解答:
解:A.乙炔的密度比空气的密度小,图中气体的收集方法不合理,故A错误;
B.乙酸、乙醇互溶,不分层,不能利用图中分液装置分离,故B错误;
C.乙酸与乙醇发生酯化反应生成乙酸乙酯,碳酸钠可除杂,降低乙酸乙酯的溶解度,则图中制备实验合理,故C正确;
D.冷水的方向应下进上出,在冷凝管中停留时间长,冷却效果好,图中不合理,故D错误;
故选C.
B.乙酸、乙醇互溶,不分层,不能利用图中分液装置分离,故B错误;
C.乙酸与乙醇发生酯化反应生成乙酸乙酯,碳酸钠可除杂,降低乙酸乙酯的溶解度,则图中制备实验合理,故C正确;
D.冷水的方向应下进上出,在冷凝管中停留时间长,冷却效果好,图中不合理,故D错误;
故选C.
点评:本题考查化学实验方案的评价,为高频考点,涉及物质的制备实验及混合物分离提纯实验等,把握物质的性质、反应原理为解答的关键,侧重性质与实验的考查,注意实验的可行性、评价性分析,题目难度不大.

练习册系列答案
 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
纽扣电池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液.放电时两个电极反应分别为:Zn+2OH-→Zn(OH)2+2e-Ag2O+H2O+2e-→2Ag+2OH-,下列说法正确的是( )
| A、锌是负极,氧化银是正极 |
| B、锌发生还原方应,氧化银发生氧化反应 |
| C、溶液中OH-向正极移动,K+、H+向负极移动 |
| D、在电池放电过程中,电解质溶液的酸碱性基本保持不变 |
铊(81T1)是元素周期表ⅢA族元素,下列关于铊的叙述不正确的是( )
| A、铊比铝的金属性更强 |
| B、铊能与盐酸反应放出氢气 |
| C、铊在化合物中可以是+3价 |
| D、氢氧化铊一定具有两性 |
向13.6gCu和Cu2O的混合物中加入某浓度的稀硝酸0.25L,固体物质完全反应,生成NO和Cu(NO3)2.在所得溶液中加入0.5mol/L的NaOH溶液1L,反应后溶液恰好呈中性,金属离子已完全沉淀,沉淀质量为19.6g,下列说法不正确的是( )
| A、Cu与Cu2O的物质的量之比为2:1 |
| B、硝酸的物质的量浓度为2 mol/L |
| C、Cu、Cu2O与硝酸反应后剩余HNO3的物质的量为0.5mol |
| D、产生的NO在标准状况下的体积为2.24L |
下列说法正确的是( )
| A、硅材料广泛用于光纤通讯 |
| B、工艺师利用盐酸刻蚀石英制作艺术品 |
| C、粗硅制备单晶硅不涉及氧化还原反应 |
| D、水晶项链和餐桌上的瓷盘都是硅酸盐制品 |
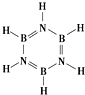 元素周期表中,金属和非金属分界线附近的元素性质特殊,其单质及化合物应用广泛,成为科学研究的热点.
元素周期表中,金属和非金属分界线附近的元素性质特殊,其单质及化合物应用广泛,成为科学研究的热点.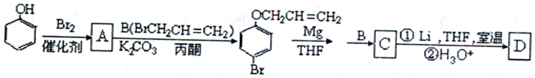
 是化合物B的一种同分异构体,用核磁共振氢谱可以证明该化合物中有
是化合物B的一种同分异构体,用核磁共振氢谱可以证明该化合物中有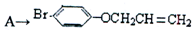 的有机反应类型
的有机反应类型