题目内容
现有浓度均为0.1mol?L-1的下列溶液:①盐酸 ②醋酸 ③氢氧化钠 ④氯化铵 ⑤硫酸氢铵 ⑥氨水,请回答下列问题:
(1)已知t℃时,Kw=1×10-13,则t℃(填“>”“<”或“=”) 25℃.
(2)②③④三种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) .
(3)④⑤⑥四种溶液中NH4+浓度由大到小的顺序是(填序号) .
(4)常温下,将①和③按体积比2:1混合后,溶液的pH约为 (已知lg3=0.5).
(1)已知t℃时,Kw=1×10-13,则t℃(填“>”“<”或“=”)
(2)②③④三种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)
(3)④⑤⑥四种溶液中NH4+浓度由大到小的顺序是(填序号)
(4)常温下,将①和③按体积比2:1混合后,溶液的pH约为
考点:水的电离,盐类水解的应用
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:(1)水的电离是吸热反应,升高温度促进水电离;
(2)酸碱抑制水的电离,可以水解的盐类促进水的电离,据此分析即可;
(3)化学式中铵根离子个数相等的强电解质中,醋酸根离子促进铵根离子水解,氢离子抑制铵根离子水解,一水合氨是弱电解质,其电离程度较小,据此解答即可;
(4)依据混合溶液pH计算方法计算即可.
(2)酸碱抑制水的电离,可以水解的盐类促进水的电离,据此分析即可;
(3)化学式中铵根离子个数相等的强电解质中,醋酸根离子促进铵根离子水解,氢离子抑制铵根离子水解,一水合氨是弱电解质,其电离程度较小,据此解答即可;
(4)依据混合溶液pH计算方法计算即可.
解答:
解:(1)水的电离是吸热反应,升高温度促进水电离,则水的离子积常数增大,t℃时,Kw=1×10-13>10-14,所以t℃>25℃,故答案为:>;
(2)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大或碱中氢氧根离子浓度越大,其抑制水电离程度越大,等浓度的这几种溶液中,NH4Cl促进水电离,醋酸中氢离子浓度小于0.1mol/L、NaOH中氢氧根离子浓度为0.1mol/L,所以②.③.④四种溶液中由水电离出的H+浓度由大到小的顺序是④②③,故答案为:④②③;
(3)化学式中铵根离子个数相等的强电解质中,醋酸根离子促进铵根离子水解,氢离子抑制铵根离子水解,一水合氨是弱电解质,其电离程度较小,所以等浓度的这几种溶液中,铵根离子浓度大小顺序是⑤④⑥,故答案为:⑤④⑥;
(4)在t℃时将0.1mol?L-1的HCl溶液与0.1mol?L-1的NaOH的溶液按体积比2:1混合(忽略混合后溶液体积的变化),则有:c(H+)=
=
mol/L,则pH=-lg
=-(-1-0.5)=1.5,故答案为:1.5.
(2)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大或碱中氢氧根离子浓度越大,其抑制水电离程度越大,等浓度的这几种溶液中,NH4Cl促进水电离,醋酸中氢离子浓度小于0.1mol/L、NaOH中氢氧根离子浓度为0.1mol/L,所以②.③.④四种溶液中由水电离出的H+浓度由大到小的顺序是④②③,故答案为:④②③;
(3)化学式中铵根离子个数相等的强电解质中,醋酸根离子促进铵根离子水解,氢离子抑制铵根离子水解,一水合氨是弱电解质,其电离程度较小,所以等浓度的这几种溶液中,铵根离子浓度大小顺序是⑤④⑥,故答案为:⑤④⑥;
(4)在t℃时将0.1mol?L-1的HCl溶液与0.1mol?L-1的NaOH的溶液按体积比2:1混合(忽略混合后溶液体积的变化),则有:c(H+)=
| 0.1×2-0.1×1 |
| 2+1 |
| 0.1 |
| 3 |
| 0.1 |
| 3 |
点评:本题考查了离子浓度大小的判断,明确弱电解质的电离及盐类水解特点是解本题关键,结合电解质强弱、溶液中的溶质解物料守恒、电荷守恒来分析解答,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、标准状况下,22.4 L H2O的分子数为1 NA |
| B、物质的量浓度为0.5 mol?L-1的MgCl2溶液,含有Cl-数为1 NA |
| C、64 g SO2中含有的氧原子数为1NA |
| D、常温常压下,14 g N2含有分子数为0.5 NA |
14.2g 69%的浓HNO3(密度为1.42g/cm3)与10mL 15.5mol/L HNO3的浓度相比( )
| A、是同一浓度的不同表示方法 |
| B、数值不同,也能换算为相同值 |
| C、不同浓度的两种硝酸溶液 |
| D、无法比较其大小 |
用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的是( )
A、 制备并收集乙炔 |
B、 除去乙醇中溶有的少量乙酸 |
C、 制备少量乙酸乙酯 |
D、 石油的分馏 |
不能用胶体的知识解释的现象是( )
| A、一支钢笔使用两种不同牌号的墨水,易出现堵塞 |
| B、向FeCl3溶液中加入NaOH溶液,出现红褐色沉淀 |
| C、医疗上常用血液透析治疗由肾功能衰竭等疾病引起的尿毒症 |
| D、江河入海处,易形成沙洲 |
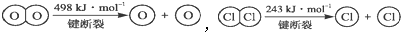 ,断开1molH-O键与断开1mol H-Cl键所需能量相差约为
,断开1molH-O键与断开1mol H-Cl键所需能量相差约为 W、Q、R、X、Y、Z六种元素的原子序数逐渐增大.已知W原子Is轨道上只有一个电子,Q、X原子p轨道的电子数分别为2和4,Z的原子序数为29,除Z外均为短周期主族元素,Y原子的价电子排布为(n+1)sn(n+1)pn.请回答下列问题:
W、Q、R、X、Y、Z六种元素的原子序数逐渐增大.已知W原子Is轨道上只有一个电子,Q、X原子p轨道的电子数分别为2和4,Z的原子序数为29,除Z外均为短周期主族元素,Y原子的价电子排布为(n+1)sn(n+1)pn.请回答下列问题: 在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.
在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.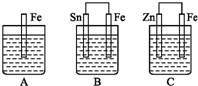 A,、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如图所示:
A,、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如图所示: