题目内容
铊(81T1)是元素周期表ⅢA族元素,下列关于铊的叙述不正确的是( )
| A、铊比铝的金属性更强 |
| B、铊能与盐酸反应放出氢气 |
| C、铊在化合物中可以是+3价 |
| D、氢氧化铊一定具有两性 |
考点:元素周期律的作用
专题:元素周期律与元素周期表专题
分析:根据同主族元素性质的递变规律:从上到下金属性依次增强,与酸反应的剧烈增强,对应最高价氧化物的水化物的碱性增强;同主族的最高正化合价相同;据此分析.
解答:
解:A.根据铊比铝在同主族,而且铊在Al的下面,所以铊比铝的金属性更强,故A正确;
B.已知Al能与盐酸反应放出氢气,所以铊能与盐酸反应放出氢气,故B正确;
C.同主族的最高正化合价相同,第ⅢA族元素的最高正化合价为+3,故C正确;
D.同主族元素从上到下金属性依次增强,对应最高价氧化物的水化物的碱性增强,氢氧化铝有两性,所以氢氧化铊没有两性,故D错误;故选D.
B.已知Al能与盐酸反应放出氢气,所以铊能与盐酸反应放出氢气,故B正确;
C.同主族的最高正化合价相同,第ⅢA族元素的最高正化合价为+3,故C正确;
D.同主族元素从上到下金属性依次增强,对应最高价氧化物的水化物的碱性增强,氢氧化铝有两性,所以氢氧化铊没有两性,故D错误;故选D.
点评:本题考查元素周期表及元素在周期表中的位置,明确元素的性质、种类即可解答,难度不大.

练习册系列答案
相关题目
在含有Na+、Cl-、K+、SO42-的混合溶液中,测得c(Na+)=2mol/L,c(K+)=2mol/L,c(Cl-)=2mol/L,则c(SO42-)等于( )
| A、1mol/L |
| B、0.5mol/L |
| C、1.5mol/L |
| D、2mol/L |
用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的是( )
A、 制备并收集乙炔 |
B、 除去乙醇中溶有的少量乙酸 |
C、 制备少量乙酸乙酯 |
D、 石油的分馏 |
液流式铅蓄电池以可溶性的甲基磺酸铅[(CH3SO3)2Pb]代替硫酸作为基质溶液,该电池充放电的总反应为
2Pb2++2H2O
Pb+PbO2+4H+,下列说法正确的是( )
2Pb2++2H2O
| 充电 |
| 放电 |
| A、该电池放电时,两极质量均增加 |
| B、放电时,正极的电极反应式为PbO2+4H++2e-═Pb2++2H2O |
| C、充电时,溶液中Pb2+向阳极移动 |
| D、充电时,阳极周围溶液的pH增大 |
下列实验操作能够达到目的是( )
| A、在某溶液中逐滴加入稀盐酸,出现白色胶状沉淀,再加入足量NaOH溶液,沉淀消失,说明原溶液中存在AlO2- |
| B、在某溶液中滴加KSCN溶液时变红色,说明溶液中不存在Fe2+ |
| C、用激光笔鉴别Fe(OH)3胶体和Fe(SCN)3溶液 |
| D、用铂丝蘸取某溶液于无色火焰上灼烧,火焰呈黄色,证明其中不含K+ |
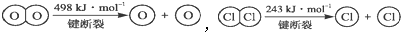 ,断开1molH-O键与断开1mol H-Cl键所需能量相差约为
,断开1molH-O键与断开1mol H-Cl键所需能量相差约为 在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.
在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.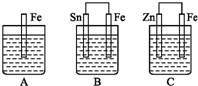 A,、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如图所示:
A,、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如图所示: