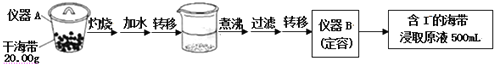
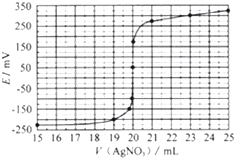
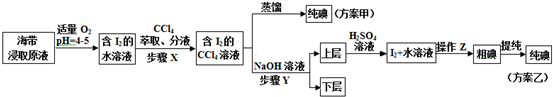
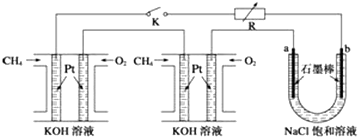
题目内容
11.36.5%浓盐酸(密度为1.18g/ml)的物质的量浓度是多少?分析 根据物质的量浓度c=$\frac{1000ρω}{M}$计算出质量分数为36.5%、密度为1.18g/mL的浓盐酸的物质的量浓度.
解答 解:盐酸的质量分数为36.5%、密度为1.18g/mL,
则该盐酸的物质的量浓度为:c=$\frac{1000ρω}{M}$=$\frac{1000×36.5%×1.18}{36.5}$mol/L=11.8mol/L,
答:36.5%浓盐酸(密度为1.18g/ml)的物质的量浓度为11.8mol/L.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的浓度与溶质质量分数的关系为解答关键,注意掌握物质的量浓度的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
19.23592U是制造原子弹的材料和核反应堆的燃料,该原子的中子数是( )
| A. | 92 | B. | 235 | C. | 143 | D. | 327 |
6.在酸性溶液中能大量共存的离子组是( )
| A. | OH-、HCO3-、Na+ | B. | Cu2+、NH4+、OH- | C. | Ba2+、K+、NO3- | D. | Ag+、Cl-、SO42- |
3.铅蓄电池的两极分别为Pb、PbO2,电解质溶液为H2SO4,工作时反应为Pb+PbO2+2H2SO4?2PbSO4+2H2O,下列结论正确的是( )
| A. | Pb为正极,发生氧化反应 | B. | SO42-只向正极移动 | ||
| C. | 电解质溶液密度不断减小 | D. | 溶液的pH不断减小 |
20.Cl2和SO2都具有漂白作用,能使品红溶液褪色.若将等物质的量的Cl2、SO2混合后,再通入品红与BaCl2的混合溶液,能观察到的现象是( )
①溶液很快褪色②溶液不褪色③出现沉淀④不出现沉淀.
①溶液很快褪色②溶液不褪色③出现沉淀④不出现沉淀.
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
1.做实验时不小心使皮肤上沾了一些高锰酸钾,形成的黑斑很久才能消除,如果用草酸(乙二酸,化学式为H2C2O4)的稀溶液洗涤,黑斑可以迅速褪去,其离子方程式为:MnO4-+H2C2O4+H+═CO2↑+Mn2++□(未配平).下列叙述不正确的是( )
| A. | 发生氧化反应的是H2C2O4 | |
| B. | 离子方程式右侧方框内的产物是H2O | |
| C. | 每消耗6 mol H+,转移5 mol电子 | |
| D. | 还原性:Mn2+<H2C2O4 |