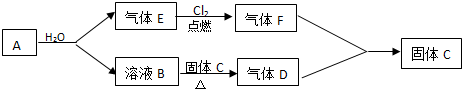
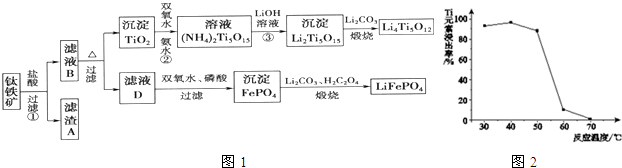
题目内容
20.Cl2和SO2都具有漂白作用,能使品红溶液褪色.若将等物质的量的Cl2、SO2混合后,再通入品红与BaCl2的混合溶液,能观察到的现象是( )①溶液很快褪色②溶液不褪色③出现沉淀④不出现沉淀.
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
分析 将等物质的量的SO2和Cl2反应生成盐酸和硫酸,再通入品红与BaCl2的混合溶液,依据生成盐酸和硫酸的性质判断发生反应及现象,硫酸和氯化钡反应会出现白色沉淀,据此解答.
解答 解:等物质的量的SO2和Cl2混合后的气体溶解于适量的蒸馏水中,发生反应:SO2+Cl2+2H2O=2HCl+H2SO4,生成盐酸和硫酸都不具有漂白性,所以不能使品红溶液,硫酸与氯化钡反应生成硫酸钡沉淀,H2SO4+BaCl2=BaSO4↓+2HCl,所以会产生白色沉淀,
故选C.
点评 本题考查氯气和二氧化硫的反应,明确二者发生反应及生成物的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
8.一定温度下在一容积不变的密闭容器中发生可逆反应2X(g)═Y(g)+Z(s),以下不能说明该反应达到化学平衡状态的是( )
| A. | v正(X)=2v正(Y) | |
| B. | 单位时间内生成1 mol Y的同时生成2molX | |
| C. | 混合气体的密度不再变化 | |
| D. | 反应容器中Y的质量分数不变 |
15.进行过滤操作时,必须使用的玻璃仪器是( )
| A. | 试管 | B. | 烧瓶 | C. | 烧杯 | D. | 酒精灯 |
5.常温下,将某一元酸HA和NaOH溶液等体积混合,实验信息如表:
下列判断不正确的是( )
| 实验编号 | c(HA)/mol•L-1 | c(NaOH)/mol•L-1 | 反应后溶液pH |
| 甲 | 0.1 | 0.1 | pH=9 |
| 乙 | c1 | 0.2 | pH=7 |
| A. | 0.1mol•L-1的HA溶液中由水电离出的c(H+)>1×10-13mol/L | |
| B. | c1一定大于0.2 mol•L-1 | |
| C. | 甲反应后的溶液中:HA占含A-微粒总数的0.01% | |
| D. | 乙反应后的溶液中:c(Na+)<c(HA)+c(A-) |
12.如图是三种有机物的结构简式
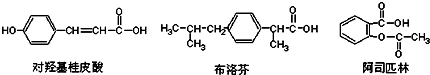
下列说法正确的是( )

下列说法正确的是( )
| A. | 三种有机物都能发生水解反应 | |
| B. | 三种有机物苯环上的氢原子若被氯原子取代,其一氯代物都只有2种 | |
| C. | 三种物质中,其中有两种互为同分异构体 | |
| D. | 三种物质在一定条件下,均可以被氧化反应 |
9.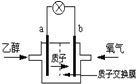 2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )
2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )
 2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )
2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )| A. | 电池工作时,1mol乙醇被氧化时就有6mol电子转移 | |
| B. | a极为电池的负极 | |
| C. | 电池工作时电流由b极沿导线经灯泡再到a极 | |
| D. | 电池正极的电极反应为:4H++O2+4e-═2H2O |