题目内容
在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO3-+5SO32-+2H+=I2+5SO42-+H2O
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.某同学设计实验如下表所示:
(1)碘酸钾与亚硫酸钠的反应是 (填反应类型);
(2)该实验的目的是① ,② ;
(3)表中V2= mL,V1= mL
(4)t1 t2 t3(填“<”、“>”或“=”)
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.某同学设计实验如下表所示:
| 0.01mol?L-1KIO3酸性溶液(含淀粉)的体积/mL | 0.01mol?L-1 Na2SO3溶液的体积/mL | H2O的体积/mL | 实验温度 /℃ | 溶液出现蓝色时所需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | t 1 |
| 实验2 | 5 | 5 | 40 | 25 | t2 |
| 实验3 | 5 | 5 | V2 | 0 | t 3 |
(2)该实验的目的是①
(3)表中V2=
(4)t1
考点:浓度、温度、催化剂对化学反应速率的影响,探究影响化学反应速率的因素
专题:实验题
分析:(1)依据所给的方程式可以判断,该反应中有化合价的变化,据此解答;
(2)依据表中数据判断实验目的,由实验2可以看出混合液的总体积为50mL,V1为10mL,V2为40mL,实验1和实验2可知实验目的是探究该反应速率与亚硫酸钠溶液浓度的关系;实验2和实验3可知实验目的是探究该反应速率与温度的关系;
(3)由实验2可以看出混合液的总体积为50mL,V1为10mL,V2为40mL,据此解答即可;
(4)温度越高,化学反应速率越快,所需时间越短,浓度越大,化学反应速率越大,据此解答即可.
(2)依据表中数据判断实验目的,由实验2可以看出混合液的总体积为50mL,V1为10mL,V2为40mL,实验1和实验2可知实验目的是探究该反应速率与亚硫酸钠溶液浓度的关系;实验2和实验3可知实验目的是探究该反应速率与温度的关系;
(3)由实验2可以看出混合液的总体积为50mL,V1为10mL,V2为40mL,据此解答即可;
(4)温度越高,化学反应速率越快,所需时间越短,浓度越大,化学反应速率越大,据此解答即可.
解答:
解:(1)反应2IO3-+5SO32-+2H+=I2+5SO42-+H2O中,有元素化合价的变化,故此反应为氧化还原反应,故答案为:氧化还原反应;
(2)实验1和实验2探究该反应速率与亚硫酸钠溶液浓度的关系,实验2和实验3探究该反应速率与温度的关系;由实验2可以看出混合液的总体积为50mL,V1为10mL,V2为40mL,实验1和实验2可知实验目的是探究该反应速率与亚硫酸钠溶液浓度的关系;实验2和实验3可知实验目的是探究该反应速率与温度的关系,
故答案为:探究该反应速率与亚硫酸钠溶液浓度;探究该反应速率与亚硫酸钠溶液温度的关系;
(3)由实验2可以看出混合液的总体积为50mL,故V1=50-35-5=10mL,V2=50-10=40mL,故答案为:40;10;
(4)温度越高,化学反应速率越快,所需时间越短,浓度越大,化学反应速率越大,实验1与实验2比较,温度一样,但是实验1中浓度大,故时间短,由于实验2中温度高于实验3中,故实验3所有时间最长,故答案为:<;<.
(2)实验1和实验2探究该反应速率与亚硫酸钠溶液浓度的关系,实验2和实验3探究该反应速率与温度的关系;由实验2可以看出混合液的总体积为50mL,V1为10mL,V2为40mL,实验1和实验2可知实验目的是探究该反应速率与亚硫酸钠溶液浓度的关系;实验2和实验3可知实验目的是探究该反应速率与温度的关系,
故答案为:探究该反应速率与亚硫酸钠溶液浓度;探究该反应速率与亚硫酸钠溶液温度的关系;
(3)由实验2可以看出混合液的总体积为50mL,故V1=50-35-5=10mL,V2=50-10=40mL,故答案为:40;10;
(4)温度越高,化学反应速率越快,所需时间越短,浓度越大,化学反应速率越大,实验1与实验2比较,温度一样,但是实验1中浓度大,故时间短,由于实验2中温度高于实验3中,故实验3所有时间最长,故答案为:<;<.
点评:本题考查了化学平衡移动等知识点,综合性高,难度大,关键在于读图获取信息,培养学生分析问题解决问题能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列物质中所含原子数最多的是( )
| A、0.3 mol SO3 |
| B、66 g CO2 |
| C、6.02×1023个NH3分子 |
| D、4℃时18 mL的水 |
用已知浓度的酸滴定未知浓度的碱时,会导致待测碱液的浓度偏低的操作是( )
①酸式滴定管用蒸馏水洗后,未用标准液润洗
②碱式滴定管用蒸馏水洗后,未用待测液润洗
③配制碱液时,称量的固体吸潮
④滴定前酸式滴定管尖嘴部分未充满溶液
⑤滴定中不慎将锥形瓶内液体摇出少量于瓶外.
①酸式滴定管用蒸馏水洗后,未用标准液润洗
②碱式滴定管用蒸馏水洗后,未用待测液润洗
③配制碱液时,称量的固体吸潮
④滴定前酸式滴定管尖嘴部分未充满溶液
⑤滴定中不慎将锥形瓶内液体摇出少量于瓶外.
| A、①③④ | B、②⑤ |
| C、②③⑤ | D、①③ |
下列叙述错误的是( )
| A、福尔马林、葡萄糖与银氨溶液共热都有光亮的银镜生成 |
B、有机物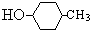 的消去产物有两种 的消去产物有两种 |
| C、鸡蛋清溶液中加入饱和(NH4)2SO4溶液后产生沉淀,是因为蛋白质发生了盐析 |
| D、沾附在试管内壁上的油脂,用热碱液洗涤 |
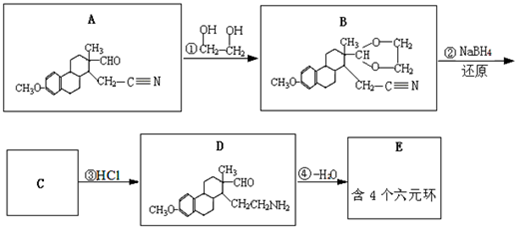
 是一种医药中间体,常用来制备抗凝血药,可通过下列流程合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列流程合成:
 是合成某些药物的中间体.试设计合理方案由化合物
是合成某些药物的中间体.试设计合理方案由化合物 合成
合成 .
.
 (提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:A→B→C…→H.)
(提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:A→B→C…→H.)