题目内容
10.1.28g铜投入一定量浓HNO3中,铜完全溶解,生成气体颜色越来越浅,共收集到672mL气体(标况),将盛有此气体的容器倒扣在水中,通入标况下一定体积的O2,恰好使气体完全溶于水中,则通入O2的体积是( )| A. | 504mL | B. | 168mL | C. | 336mL | D. | 224mL |
分析 Cu与硝酸反应是硝酸铜与氮的氧化物,而氮的氧化物倒扣在水中,通入氧气,恰好使气体完全溶于水中,又生成硝酸,纵观整个反应过程可知,铜提供的电子等于通入的氧气获得的电子,根据n=$\frac{m}{M}$计算1.28g铜的物质的量,利用电子转移守恒计算通入氧气的物质的量,再根据V=nVm计算.
解答 解:1.28g铜的物质的量=$\frac{1.28g}{64g/mol}$=0.02mol,
Cu与硝酸反应是硝酸铜与氮的氧化物,而氮的氧化物倒扣在水中,通入氧气,恰好使气体完全溶于水中,又生成硝酸,纵观整个反应过程可知,铜提供的电子等于通入的氧气获得的电子,
则通入氧气的物质的量为:$\frac{0.02mol×2}{4}$=0.01mol,
所以需要通入氧气的体积为:0.01mol×22.4L/mol=0.224L=224mL,
故选D.
点评 本题考查氧化还原反应有关计算,题目难度中等,得出Cu失去电子数目等于O2获得电子之和是解答本题的关键,试题培养了学生的化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.下列说法正确的是( )
| A. | 陶瓷、水泥、石英玻璃、光导纤维均属于硅酸盐产品 | |
| B. | 煤干馏得到的煤焦油,其主要用途是经蒸馏得到燃油,这一应用可体现“低碳生活”的理念 | |
| C. | 埃博拉病毒对化学药品敏感,乙醇、酚类、次氯酸钠溶液、双氧水均可以将病毒氧化而达到消毒的目的 | |
| D. | 扫描隧道显微技术、超分辨荧光显微技术等科技手段的发展,促进了人类对微观结构的探索,可实现对原子或分子的操控,使科学研究迈入更高水平 |
18.水溶液中能大量共存的一组离子是( )
| A. | Na+、Al3+、Cl-、CO32- | B. | Na+、Fe3+、Cl-、NO3- | ||
| C. | H+、Na+、ClO-、S2- | D. | K+、NH4+、OH-、SO42- |
5. 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液的颜色变化,直到因加入一滴盐酸后,溶液由红色变为无色,并半分钟内不褪色为止.
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是D(填字母序号).
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
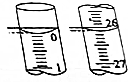
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为0.00mL,终点读数为26.10mL,所用盐酸溶液的体积为26.10mL.
(4)某学生根据3次实验分别记录有关数据如下表:
依据上表数据列式计算该NaOH溶液的物质的量浓度.
 某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂.请填写下列空白:(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶内溶液的颜色变化,直到因加入一滴盐酸后,溶液由红色变为无色,并半分钟内不褪色为止.
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是D(填字母序号).
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示,则起始读数为0.00mL,终点读数为26.10mL,所用盐酸溶液的体积为26.10mL.
(4)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.1000mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
15.已知X、Y、Z、W均为元素周期表中的短周期元素,具有如下特征:
(1)W的元素符号是S,其原子结构示意图为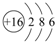 .
.
(2)四种元素中,原子半径最大的是Na(填元素符号).
(3)X2Y的电子式是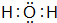 .
.
(4)Z2Y2中含有化学键的类型是离子键、共价键.
(5)Y的非金属性强(填“强”或“弱”)于W.请用原子结构的知识解释其原因:O原子比S原子少一个电子层数,O原子半径较大,得电子能力较强.
(6)将WY2通入BaCl2溶液中,没有明显变化,再向其中加入Z元素最高价氧化物对应的水化物,可观察到的现象是有白色沉淀生成,发生反应的离子方程式是SO2+2OH-+Ba2+=BaSO3↓+H2O.
| 元素 | 特征 |
| X | 周期表中,原子半径最小 |
| Y | 常温下,可以形成Y2、Y3型的气体单质 |
| Z | 其原子内层电子与最外层电子数之比为10:1 |
| W | 最高化合价为+6 |
 .
.(2)四种元素中,原子半径最大的是Na(填元素符号).
(3)X2Y的电子式是
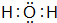 .
.(4)Z2Y2中含有化学键的类型是离子键、共价键.
(5)Y的非金属性强(填“强”或“弱”)于W.请用原子结构的知识解释其原因:O原子比S原子少一个电子层数,O原子半径较大,得电子能力较强.
(6)将WY2通入BaCl2溶液中,没有明显变化,再向其中加入Z元素最高价氧化物对应的水化物,可观察到的现象是有白色沉淀生成,发生反应的离子方程式是SO2+2OH-+Ba2+=BaSO3↓+H2O.
2.25℃时,下列有关溶液中粒子的物质的量浓度关系不正确的是( )
| A. | 氨水与盐酸恰好中和后的溶液:c(H+)>c(OH-) | |
| B. | 0.2mol/L醋酸溶液与0.1mol/L NaOH溶液等体积混合后的溶液:c(CH3COO-)+c(CH3COOH)=0.2mol/L | |
| C. | NaHSO3溶液(呈酸性):c(Na+)>c(HSO3-)>c(H+)>c(OH-) | |
| D. | NaHSO4溶液滴入氨水后的溶液:c(H+)+c(NH4+)=2c(SO42-)+c(OH-). |
 g含有b个分子,则
g含有b个分子,则 g该混合气体在相同状况下所占的体积(L)应是
g该混合气体在相同状况下所占的体积(L)应是 B.
B. C.
C. D.
D.