题目内容
关于平衡常数,下列说法不正确的是( )
| A、平衡常数随温度的改变而改变 |
| B、使用催化剂不能改变平衡常数 |
| C、平衡常数不随反应物或生成物浓度的改变而改变 |
| D、增大压强促使平衡向正反应方向进行,则平衡常数增大 |
考点:化学平衡常数的含义
专题:化学平衡专题
分析:平衡常数是衡量化学平衡进行程度的物理量,随温度变化,不随浓度、压强、催化剂等因素的影响;
解答:
解:A、平衡常数随温度的改变而改变,故A正确;
B、使用催化剂只改变反应速率,不改变平衡,不能使平衡常数增大,故B正确;
C、平衡常数不随反应物或生成物的浓度的改变而改变,故C正确;
D、平衡常数不随压强的改变而改变,故D错误;
故选D.
B、使用催化剂只改变反应速率,不改变平衡,不能使平衡常数增大,故B正确;
C、平衡常数不随反应物或生成物的浓度的改变而改变,故C正确;
D、平衡常数不随压强的改变而改变,故D错误;
故选D.
点评:本题考查了化学平衡常数的含义和概念分析应用,题目较简单.

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案
相关题目
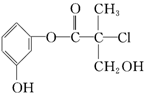 某有机物是药物生产的中间体,其结构简式如图.下列有关叙述正确的是( )
某有机物是药物生产的中间体,其结构简式如图.下列有关叙述正确的是( )| A、该有机物能与溴水发生加成反应 |
| B、该有机物与浓硫酸混合加热可发生消去反应 |
| C、1mol该有机物与足量NaOH溶液反应最多消耗3mol NaOH |
| D、该有机物经催化氧化后能发生银镜反应 |
用坩埚钳夹住一小块刚用酸充分处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝并不滴落.下列关于上述实验现象的解释正确的是( )
| A、火焰温度太低不能使铝燃烧 |
| B、铝在空气中能很快形成氧化膜 |
| C、氧化铝的熔点比铝的熔点低 |
| D、用酸处理时未能将氧化铝溶解 |
对于反应A (g)+3B(g)=2C(g)+2D(g),下列数据表示反应进行得最快的是( )
| A、v(A)=0.7mol/(L?s) |
| B、v(B)=1.8mol/(L?s) |
| C、v(C)=1mol/(L?s) |
| D、v(D)=1.6mol/(L?min) |
对于物质的量浓度为1mol.L-1的H2SO4而言,下列不正确的是( )
| A、1L溶液里含有2 mol H+ |
| B、0.5L溶液中含49克H2SO4 |
| C、溶液中c(H+)与c(SO42-)之比为2:1 |
| D、溶液中含98克H2SO4 |
已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3kJ/mol,则下列说法中正确的是( )
| A、浓硫酸和NaOH溶液反应,生成1mol水时放热57.3kJ |
| B、含1mol H2SO4的稀硫酸与足量稀NaOH溶液中和后,放热为57.3 kJ |
| C、1L 0.1mol/L CH3COOH与1L 0.1mol/L NaOH溶液反应后放热为5.73 kJ |
| D、1L 0.1 mol/L HNO3与1L 0.1mol/L NaOH溶液反应后放热为5.73 kJ |
下列变化属于氧化还原反应,但不属于四种基本反应类型的是( )
A、CO+CuO
| ||||
B、2Al+Fe2O3
| ||||
C、2O3
| ||||
| D、Cl2+2FeCl2═2FeCl3 |
分别在等体积等pH或等物质的量浓度的盐酸和醋酸溶液中,加入足量锌粉,氢离子浓度c(H+)及氢气的体积V(H2)(同温同压下测定)的变化图示如下,其中正确的是( ) 

| A、①②③ | B、②④ |
| C、①③ | D、①②③④ |
在一定温度下的密闭容器中存在如下反应:2SO2(g)+O2(g)
2SO3(g),已知c(SO2)始=0.4mol?L-1,c(O2)始=1mol?L-1经测定该反应在该温度下的平衡常数K=19,则此反应中SO2的转化量为( )
| ||
| △ |
| A、0.24mol?L-1 |
| B、0.28mol?L-1 |
| C、0.32mol?L-1 |
| D、0.26mol?L-1 |