题目内容
海水中富含氯元素.
(1)KCl广泛应用于医药和农业,KCl晶体中基态的Cl-电子排布式为
(2)下列是部分金属元素的电离能
已知X、Y、Z的价层电子构型为nS1,则三种金属的氯化物(RCl)的熔点由高到低的顺序为 .
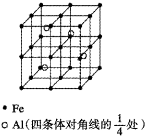
(3)RCl用作有机机合成催化剂,并用于颜料,防腐等工业.R+中所有电子正好充满K、L、M三个电子层,它与Cl-形成的晶体结构如图所示.R的元素符号是 ,与同一个Cl-相连的R+有 个.
(4)卤代烃在有机合成中作用巨大,烃基的结构对卤代烃的活性有很大的影响.CH3-CH2-Cl和碱溶液容易发生取代反应,而CH2=CH-Cl和碱溶液不起作用,请从结构上解释其差异
(5)HCl和HF结构相似,由于氢键的存在使两者性质上存在较大差异,请列举出由于氢键的影响导致的性质差异 .
(1)KCl广泛应用于医药和农业,KCl晶体中基态的Cl-电子排布式为
(2)下列是部分金属元素的电离能
| X | Y | Z | |
| 第一电离能(KJ/mol) | 520.2 | 495.8 | 418.8 |

(3)RCl用作有机机合成催化剂,并用于颜料,防腐等工业.R+中所有电子正好充满K、L、M三个电子层,它与Cl-形成的晶体结构如图所示.R的元素符号是
(4)卤代烃在有机合成中作用巨大,烃基的结构对卤代烃的活性有很大的影响.CH3-CH2-Cl和碱溶液容易发生取代反应,而CH2=CH-Cl和碱溶液不起作用,请从结构上解释其差异
(5)HCl和HF结构相似,由于氢键的存在使两者性质上存在较大差异,请列举出由于氢键的影响导致的性质差异
考点:晶胞的计算,晶体熔沸点的比较,含有氢键的物质
专题:化学键与晶体结构
分析:(1)Cl-离子核外电子数为18,根据构造原理书写其核外电子排布式;
(2)X、Y、Z的价层电子构型为nS1,处于ⅠA族,自上而下第一电离能减小,故原子序数X>Y>Z,它们的氯化物(RCl)属于离子化合物,根据离子半径对晶格能的影响判断熔点高低;
(3)R+中所有电子正好充满K、L、M三个电子层,则R原子质子数=2+8+18+1=29,则R为铜;根据晶胞结构可知,每个R+相连4个Cl-,该化合物为CuCl,属于1:1型结构,则每个Cl-相连4个R+;
(4)根据与Cl原子相连的C原子的电子云密度、C-Cl的键长及π键、σ键对C-Cl键的影响判断;
(5)根据氢化物沸点、酸性及相对分子质量实验测定值等解答.
(2)X、Y、Z的价层电子构型为nS1,处于ⅠA族,自上而下第一电离能减小,故原子序数X>Y>Z,它们的氯化物(RCl)属于离子化合物,根据离子半径对晶格能的影响判断熔点高低;
(3)R+中所有电子正好充满K、L、M三个电子层,则R原子质子数=2+8+18+1=29,则R为铜;根据晶胞结构可知,每个R+相连4个Cl-,该化合物为CuCl,属于1:1型结构,则每个Cl-相连4个R+;
(4)根据与Cl原子相连的C原子的电子云密度、C-Cl的键长及π键、σ键对C-Cl键的影响判断;
(5)根据氢化物沸点、酸性及相对分子质量实验测定值等解答.
解答:
解:(1)Cl-离子核外电子数为18,核外电子排布式为1s22s22p63s23p6,故答案为:1s22s22p63s23p6;
(2)X、Y、Z的价层电子构型为nS1,处于ⅠA族,自上而下第一电离能减小,故原子序数X>Y>Z,根据离子半径X>Y>Z,则晶格能ZCl>YCl>XCl,故熔点ZCl>YCl>XCl,故答案为:ZCl>YCl>XCl;
(3)R+中所有电子正好充满K、L、M三个电子层,则R原子质子数=2+8+18+1=29,则R为Cu;根据晶胞结构可知,每个R+相连4个Cl-,该化合物为CuCl,属于1:1型结构,则每个Cl-相连4个R+,
故答案为:Cu;4;
(4)CH3-CH2-Cl中与Cl原子相连的C原子采取sp3杂化,而CH2=CH-Cl中与Cl原子相连的C原子采取sp2杂化,电子云密度相对较大,CH3-CH2-Cl中与C-Cl键长比CH2=CH-Cl中C-Cl长,CH2=CH-Cl中π键对Cl原子的作用力比σ键强等,导致CH3-CH2-Cl和碱溶液容易发生取代反应,而CH2=CH-Cl和碱溶液不起作用,
故答案为:CH3-CH2-Cl中与Cl原子相连的C原子采取sp3杂化,而CH2=CH-Cl中与Cl原子相连的C原子采取sp2杂化,电子云密度相对较大,CH3-CH2-Cl中与C-Cl键长比CH2=CH-Cl中C-Cl长,CH2=CH-Cl中π键对Cl原子的作用力比σ键强;
(5)HF分子之间存在氢键,其沸点比HCl高,水溶液中氢氟酸为弱酸,而盐酸为强酸,氟化氢分子之间存在[HF]n缔合体,测定的相对分子质量偏大,
故答案为:HF沸点比HCl高;氢氟酸为弱酸,而盐酸为强酸;测定HF的相对分子质量比实际偏大.
(2)X、Y、Z的价层电子构型为nS1,处于ⅠA族,自上而下第一电离能减小,故原子序数X>Y>Z,根据离子半径X>Y>Z,则晶格能ZCl>YCl>XCl,故熔点ZCl>YCl>XCl,故答案为:ZCl>YCl>XCl;
(3)R+中所有电子正好充满K、L、M三个电子层,则R原子质子数=2+8+18+1=29,则R为Cu;根据晶胞结构可知,每个R+相连4个Cl-,该化合物为CuCl,属于1:1型结构,则每个Cl-相连4个R+,
故答案为:Cu;4;
(4)CH3-CH2-Cl中与Cl原子相连的C原子采取sp3杂化,而CH2=CH-Cl中与Cl原子相连的C原子采取sp2杂化,电子云密度相对较大,CH3-CH2-Cl中与C-Cl键长比CH2=CH-Cl中C-Cl长,CH2=CH-Cl中π键对Cl原子的作用力比σ键强等,导致CH3-CH2-Cl和碱溶液容易发生取代反应,而CH2=CH-Cl和碱溶液不起作用,
故答案为:CH3-CH2-Cl中与Cl原子相连的C原子采取sp3杂化,而CH2=CH-Cl中与Cl原子相连的C原子采取sp2杂化,电子云密度相对较大,CH3-CH2-Cl中与C-Cl键长比CH2=CH-Cl中C-Cl长,CH2=CH-Cl中π键对Cl原子的作用力比σ键强;
(5)HF分子之间存在氢键,其沸点比HCl高,水溶液中氢氟酸为弱酸,而盐酸为强酸,氟化氢分子之间存在[HF]n缔合体,测定的相对分子质量偏大,
故答案为:HF沸点比HCl高;氢氟酸为弱酸,而盐酸为强酸;测定HF的相对分子质量比实际偏大.
点评:本题考查物质结构与性质,涉及核外电子排布、电离能、熔点比较、化学键、晶胞结构等,(4)从结构分析性质差异为易错点、难点.

练习册系列答案
相关题目
用nA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A、23g NO2和N2O4的混合气体中含有的氮原子数为0.5nA |
| B、4.2g丙烯中所含的共价键数目为0.6nA |
| C、1L 0.1mol/L的Fe2(SO4)3溶液中,Fe3+的数目为0.2nA |
| D、过氧化氢分解制得标准状况下1.12L O2,转移电子数目为 0.2nA |
用NA代表阿伏加德罗常数,下列说法中正确的是( )
| A、1L 0.5mol/L FeCl3溶液中含Fe3+的数目为0.5NA |
| B、34g10%的双氧水中,含有的共价键数目为3NA |
| C、氯化钠晶体中一个钠离子周围距离最近的氯离子的数目为6个 |
| D、用含有0.1 mol FeCl3的饱和溶液制得的氢氧化铁胶体中,胶粒数等于0.1NA |
设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
| A、常温常压下,1mol甲基(-CH3)所含电子数为7NA |
| B、0.4 mol以任意比例混合的乙炔和乙醛气体充分燃烧时,消耗氧气分子数为NA |
| C、常温常压下,NA个甲烷分子的体积大于22.4 L |
| D、1 mol Na2O2与水反应,转移的电子数为NA |
由FeSO4和Fe2(SO4)3组成的混合物中,含硫为a%,则所含铁的质量百分含量为( )
| A、3a% |
| B、(100-2a)% |
| C、20% |
| D、1-3a% |
 组成蛋白质的元素主要有C、H、O、N及S、P和少量的Zn、Cu、Fe等.
组成蛋白质的元素主要有C、H、O、N及S、P和少量的Zn、Cu、Fe等.
 [化学一物质结构与性质]
[化学一物质结构与性质]