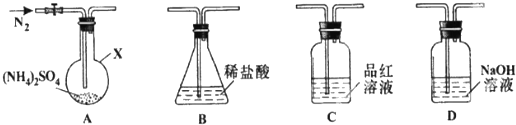
题目内容
19.下列设计的实验方案能达到实验目的是( )| A. | 检验某有机物中是否含有醛基:取少量水溶液于试管中,加入过量氢氧化钠溶液和新制Cu(OH)2悬浊液,加热至沸腾,看是否有砖红色沉淀生成 | |
| B. | 提纯混有少量CaCl2的NaCl固体:将固体配成溶液,加入稍过量Na2CO3溶液至沉淀完全,过滤,再向滤液中加入稍过量盐酸,蒸发结晶 | |
| C. | 验证某无色溶液中存在SO42-:向试管中加入少量待测溶液,然后加入少量BaCl2溶液,后加入足量稀硝酸,观察到最后仍有白色沉淀生成即可 | |
| D. | 验证炭与浓硫酸反应产生的CO2:将炭与浓硫酸反应生成的气体通入盛有澄清石灰水的试管中,观察是否有白色沉淀生成 |
分析 A.在保证溶液呈碱性的条件下可直接加入新制Cu(OH)2悬浊液;
B.氯化钙和碳酸钠反应生成碳酸钙沉淀,过滤后加入盐酸可除去碳酸钠;
C.加入少量BaCl2溶液,可生成AgCl沉淀;
D.炭与浓硫酸反应生成二氧化硫,也可与澄清石灰水反应生成沉淀.
解答 解:A.在保证溶液呈碱性的条件下可直接加入新制Cu(OH)2悬浊液,无需加入氢氧化钠溶液,故A错误;
B.氯化钙和碳酸钠反应生成碳酸钙沉淀,过滤后加入盐酸可除去碳酸钠,蒸发结晶可得到氯化钠,故B正确;
C.加入少量BaCl2溶液,可生成AgCl沉淀,应先加入盐酸,如无现象再加入氯化钡溶液检验,故C错误;
D.炭与浓硫酸反应生成二氧化硫,也可与澄清石灰水反应生成沉淀,应将反应后的气体先通过高锰酸钾除去二氧化硫,用品红检验是否完全除去,然后再用澄清石灰水检验,故D错误.
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及物质的检验、分离提纯等,把握反应原理及反应与现象的关系为解答的关键,注意从实验的评价性及物质性质分析解答,题目难度不大.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案
相关题目
9.NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 1 L 0.2 mol•L-1硫酸铁溶液中含有的SO42-数为0.6NA | |
| B. | 60 g SiO2晶体中含有2NA个Si-O键 | |
| C. | 1L浓度为1mol•L-1的Na2CO3溶液中含有NA个CO32- | |
| D. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA |
10.实验室有两瓶失去标签的溶液,其中一瓶是食盐水,另一瓶是蔗糖水.以下鉴别方法不正确的是( )
| A. | 在两种溶液中分别加入少量稀硫酸,加热,再加入碱中和硫酸,再加入银氨溶液,水浴加热 | |
| B. | 测量溶液的导电性 | |
| C. | 向两种溶液中分别滴加硝酸银溶液 | |
| D. | 尝味道 |
4.下列关于液氯和氯水的叙述中正确的是( )
| A. | 液氯是纯净物,而氯水是混合物 | B. | 液氯有酸性,氯水有漂白性 | ||
| C. | 液氯较氯水的漂白作用更强 | D. | 液氯无色,氯水呈黄绿色 |
11.下列说法正确的是( )
| A. | NH3可以用来做喷泉实验是因为其有特殊气味 | |
| B. | 工业上用氨和二氧化碳合成尿素属于氮的固定 | |
| C. | 液氨作制冷剂原因是其气化时大量吸收周围的热量 | |
| D. | NH3能使无色酚酞溶液变红 |
8.现拟分离乙酸乙酯、乙酸、乙醇的混合物,图是分离操作流程图.
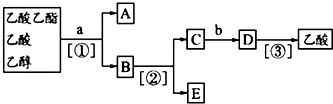
上述实验过程中涉及的三次分离操作分别是( )

上述实验过程中涉及的三次分离操作分别是( )
| A. | ①蒸馏 ②过滤 ③分液 | B. | ①分液 ②蒸馏 ③蒸馏 | ||
| C. | ①蒸馏 ②分液 ③分液 | D. | ①分液 ②蒸馏 ③结晶 过滤 |
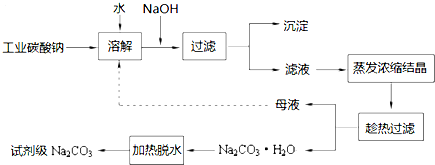
9.工业碳酸钠(纯度约为98%)中常含有Ca2+、Mg2+、Fe3+、Clˉ和SO42ˉ等杂质.为了提纯工业碳酸钠,并获得试剂级碳酸钠,采取工艺流程如图所示:
已知:Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
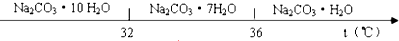
Ⅱ.有关物质的溶度积如下
(1)加入NaOH溶液主要为了除去Mg2+(填离子符号),发生反应的离子方程式为MgCO3+2OH-=Mg(OH)2+CO32-、Mg2++2OH-=Mg(OH)2↓;“沉淀”的主要成份有Mg(OH)2、Fe(OH)3、CaCO3(填化学式);
向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.125×1021.
(2)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释)Na2CO3在溶液中存在水解平衡CO32-+H2O?HCO3-+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强.
(3)“趁热过滤”时的温度应控制在高于36℃.
(4)已知:Na2CO3•10H2O(s)=Na2CO3(s)+10H2O(g)△H=+532.36kJ•mol-1
Na2CO3•10H2O(s)=Na2CO3•H2O(s)+9H2O(g)△H=+473.63kJ•mol-1
写出Na2CO3•H2O脱水反应的热化学方程式Na2CO3•H2O(s)=Na2CO3(s)+H2O(g)△H=+58.73KJ/mol.
(5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用.请你分析实际生产中是否可行不可行,其理由是若“母液”循环使用,则溶液c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质.

已知:Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如下图所示:
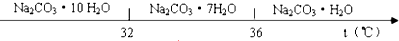
Ⅱ.有关物质的溶度积如下
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.125×1021.
(2)热的Na2CO3溶液有较强的去油污能力,其原因是(用离子方程式及必要的文字加以解释)Na2CO3在溶液中存在水解平衡CO32-+H2O?HCO3-+OH-,溶液呈碱性,当温度升高时水解平衡正向移动,使溶液碱性增强,故去油污能力增强.
(3)“趁热过滤”时的温度应控制在高于36℃.
(4)已知:Na2CO3•10H2O(s)=Na2CO3(s)+10H2O(g)△H=+532.36kJ•mol-1
Na2CO3•10H2O(s)=Na2CO3•H2O(s)+9H2O(g)△H=+473.63kJ•mol-1
写出Na2CO3•H2O脱水反应的热化学方程式Na2CO3•H2O(s)=Na2CO3(s)+H2O(g)△H=+58.73KJ/mol.
(5)有人从“绿色化学”角度设想将“母液”沿流程图中虚线所示进行循环使用.请你分析实际生产中是否可行不可行,其理由是若“母液”循环使用,则溶液c(Cl-)和c(SO42-)增大,最后所得产物Na2CO3中混有杂质.