题目内容
9.下列颜色变化与氧化还原反应无关的是( )| A. | 将乙醛加入新制Cu(OH)2悬浊液中并加热至沸腾,出现红色沉淀 | |
| B. | 将乙醇滴入酸性K2Cr2O7溶液中,溶液由橙色变为绿色 | |
| C. | 将SO2通入滴有酚酞的NaOH溶液中,溶液红色褪去 | |
| D. | 新制氯水敞口处久置,颜色褪去 |
分析 与氧化还原反应无关,说明该反应中没有电子转移,其特征是没有元素化合价升降,据此分析解答.
解答 解:A.CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O,该反应中C元素化合价由-1价变为0价、Cu元素化合价由+2价变为+1价,所以有电子转移,属于氧化还原反应,故A不选;
B.2K2Cr2O7+3C2H5OH+8H2SO4=2K2SO4+2Cr2(SO4)3+3CH3COOH+11H2O,Cr2O72-转化为Cr3+,C元素化合价由-2价变为0价,有电子转移,所以属于氧化还原反应,故B不选;
C.2NaOH+SO2=Na2SO3+H2O,该反应中各元素化合价不变,没有电子转移,所以不属于氧化还原反应,故C选;
D.氯气与水反应生成次氯酸和盐酸,次氯酸不稳定,见光分解,平衡正向移动,颜色褪去,故D不选;
故选C.
点评 本题考查了氧化还原反应的判断,根据元素化合价是否变化判断即可,注意有机物中元素化合价的判断,取平均化合价,为易错点.

练习册系列答案
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
17.X、Y、Z、W和N均是由短周期元素组成的五种化合物.已知五种化合物水溶液的焰色反应均呈黄色,Y、Z和N均由三种元素组成.请根据题目要求回答下列问题.
(1)固体化合物X为浅黄色粉末,该化合物中含有的化学键有AC(填序号).
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(2)写出X与二氧化碳反应的化学方程式2CO2+2Na2O2═2Na2CO3+O2.
(3)下表为Y与Z实验的部分内容:
写出Y与稀硫酸反应的离子方程式S2O32-+2H+═S↓+SO2↑+H2O.
(4)写出含0.1mol Z的溶液与20mL 5mol•L-1的盐酸反应的离子反应式AlO2-+H++H2O═Al(OH)3↓.实验③加热蒸发、灼烧得到的最终产物主要是Al2O3.
(1)固体化合物X为浅黄色粉末,该化合物中含有的化学键有AC(填序号).
A.离子键 B.极性共价键 C.非极性共价键 D.氢键
(2)写出X与二氧化碳反应的化学方程式2CO2+2Na2O2═2Na2CO3+O2.
(3)下表为Y与Z实验的部分内容:
| 序号 | 主要实验步骤及实验现象 |
| ① | 在含Y的溶液中,加入稀硫酸放置,产生浅黄色沉淀和无色有刺激性气味的气体,该气体可使品红溶液褪色 |
| ② | 在含Z的溶液中,滴加盐酸,开始有白色沉淀,继续滴加盐酸,白色沉淀先增加后消失,然后加入过量的氨水又出现白色沉淀 |
| ③ | 将实验②最终得到的混合物加热蒸发、灼烧,最终得到白色固体 |
(4)写出含0.1mol Z的溶液与20mL 5mol•L-1的盐酸反应的离子反应式AlO2-+H++H2O═Al(OH)3↓.实验③加热蒸发、灼烧得到的最终产物主要是Al2O3.
14.短周期元素W、X、Y、Z在元素周期表中的位置如图所示.其中Z的单质是一种重要半导体材料.广泛应用于电子工业的各个领域.
(1)W在元素周期表中的位置是第二周期第ⅣA族;
(2)W、X、氢元素形成的三原子分子的电子式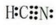 ;
;
(3)下列选项中,能证明元素非金属性X强于W的是CD;
A.原子序数:X>W
B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W
D.最高价氧化物的水化物酸性:X>W
(4)元素周期表中与Z同周期的某金属元素形成的单质A,可发生如图所示的转化:
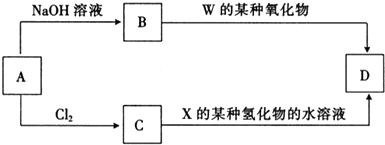
其中化合物D是一种白色沉淀,则B中溶质的化学式为NaAlO2;B与C也可直接转化生成D,写出对应的离子方程式为Al3++6H2O+3AlO2-=4Al(OH)3↓.
| W | X | ||
| Y | Z |
(2)W、X、氢元素形成的三原子分子的电子式
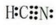 ;
;(3)下列选项中,能证明元素非金属性X强于W的是CD;
A.原子序数:X>W
B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W
D.最高价氧化物的水化物酸性:X>W
(4)元素周期表中与Z同周期的某金属元素形成的单质A,可发生如图所示的转化:

其中化合物D是一种白色沉淀,则B中溶质的化学式为NaAlO2;B与C也可直接转化生成D,写出对应的离子方程式为Al3++6H2O+3AlO2-=4Al(OH)3↓.
1.下表为各物质中所含有的少量杂质以及除去这些杂质应选用的试剂或操作方法.正确的一组为( )
| 序号 | 物质 | 杂质 | 除杂质应选用的试剂或操作方法 |
| A | CCl4 | Br2 | 用NaOH溶液洗涤、分液 |
| B | FeCl3 | CaCO3 | 溶解、过滤、蒸发结晶 |
| C | Al2(SO4)3溶液 | MgSO4 | 加入过量烧碱后过滤,再用硫酸酸化滤液 |
| D | CO2 | SO2 | 通过盛有品红溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶 |
| A. | A | B. | B | C. | C | D. | D |
18.下列物质中,没有固定沸点的是( )
| A. | 正已烷 | B. | 苯 | C. | 汽油 | D. | 乙烯 |
19.分子式为C4H10O的醇与苯甲酸( )在一定条件下反应生成酯的种类有( )
)在一定条件下反应生成酯的种类有( )
 )在一定条件下反应生成酯的种类有( )
)在一定条件下反应生成酯的种类有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |