题目内容
5.按照要求将相应序号填入空白中:①35Cl②金刚石③CO④CO2⑤37Cl⑥${\;}_{6}^{14}$C⑦SO2⑧${\;}_{7}^{14}$N⑨石墨
(1)①⑤互为同位素
(2)④⑦为酸性氧化物
(3)⑥⑧的质量数相等,但不能互为同位素
(4)②⑨互称同素异形体.
分析 (1)质子数相同质量数(或中子数)不同的原子互称同位素;
(2)氧化物只有两种元素,且必须有氧元素,酸性氧化物是与碱反应生成盐和水的氧化物,溶于水一般生成酸的氧化物;
(3)元素左上角数字为质量数;
(4)同种元素形成的不同单质互为同素异形体.
解答 解:(1)元素左上角数字为质量数,①35Cl⑤37Cl质子数都为17,中子数分别为18、20,互为同位素,
故答案为:①⑤;
(2)③CO④CO2⑦SO2,都只有两种元素,且有氧元素,但CO不与碱反应,所以④CO2⑦SO2为酸性氧化物,
故答案为:④⑦;
(3)元素左上角数字为质量数,⑥${\;}_{6}^{14}$C、⑧${\;}_{7}^{14}$N质子数分别为6、7,质量数数都为14、20,质量数相等,但不能互为同位素,
故答案为:⑥⑧;
(4)②金刚石⑨石墨都是由碳元素组成的单质,属于同素异形体,
故答案为:②⑨.
点评 本题考查物质的类别,题目难度不大,掌握相关概念是解答关键,侧重考查学生的辨别能力,选项多,要细心排查.

练习册系列答案
相关题目
15.根据等电子原理,由短周期元素组成的粒子,只要其电子总数相同,均可互称为等电子体.等电子体之间结构相似、物理性质也相近.以下各组粒子不能互称为等电子体的( )
| A. | CO和N2 | B. | N2H4 和C2H4 | C. | CO2和N2O | D. | O3和SO2 |
16.下列有关化学用语正确的是( )
| A. | 离子结构示意图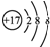 :可以表示35Cl-,也可以表示37Cl- :可以表示35Cl-,也可以表示37Cl- | |
| B. | 电子式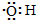 :可以表示羟基,也可以表示氢氧根离子 :可以表示羟基,也可以表示氢氧根离子 | |
| C. | 比例模型 :可以表示甲烷分子,也可以表示四氯化碳分子 :可以表示甲烷分子,也可以表示四氯化碳分子 | |
| D. | 聚丙烯的结构简式: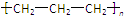 |
20.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1molCl2参加反应转移电子数不一定为2NA | |
| B. | 在16g18O2中含有10NA个中子 | |
| C. | 标准状况下,22.4L HF中含2NA个原子 | |
| D. | 3mol单质Fe完全转变为Fe3O4,失去9NA个电子 |
10.化学与生活、生产实际密切相关.下列有关说法不正确的是( )
| A. | 光导纤维应避免在强碱环境中使用 | |
| B. | 船体镀锌或镀锡均可保护船体,镀层破损后将立即失去保护作用 | |
| C. | 利用碳酸酯聚合材料生产一次性饭盒,可以减少对环境产生的白色污染 | |
| D. | 油脂皂化生成的高级脂肪酸钠是肥皂的有效成分 |
17.钒是一种重要的合金元素,还用于催化剂和新型电池.从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如图1:

部分含钒化合物在水中的溶解性如表:
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有VO2+和Al3+.
(2)反应②碱浸后滤出的固体主要成分是Al(OH)3(写化学式).
(3)反应④的离子方程式为VO3-+NH4+=NH4VO3↓.
(4)25℃、101 kPa时,4Al(s)+3O2(g)═2Al2O3(s)△H1=-a kJ/mol
4V(s)+5O2(g)═2V2O5(s)△H2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$kJ/mol.
(5)钒液流电池(如图2所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过.电池放电时负极的电极反应式为V2+-e-=V3+,电池充电时阳极的电极反应式是VO2+-e-+H2O=VO2++2H+.
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO${\;}_{2}^{+}$+H2C2O4+2H+═2VO2++2CO2↑+2H2O.取25.00mL0.1000 mol/L
H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0mL,由此可知,该(VO2)2SO4溶液中钒的含量为10.6g/L.

部分含钒化合物在水中的溶解性如表:
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
(1)反应①所得溶液中除H+之外的阳离子有VO2+和Al3+.
(2)反应②碱浸后滤出的固体主要成分是Al(OH)3(写化学式).
(3)反应④的离子方程式为VO3-+NH4+=NH4VO3↓.
(4)25℃、101 kPa时,4Al(s)+3O2(g)═2Al2O3(s)△H1=-a kJ/mol
4V(s)+5O2(g)═2V2O5(s)△H2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$kJ/mol.
(5)钒液流电池(如图2所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过.电池放电时负极的电极反应式为V2+-e-=V3+,电池充电时阳极的电极反应式是VO2+-e-+H2O=VO2++2H+.
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO${\;}_{2}^{+}$+H2C2O4+2H+═2VO2++2CO2↑+2H2O.取25.00mL0.1000 mol/L
H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0mL,由此可知,该(VO2)2SO4溶液中钒的含量为10.6g/L.
14.分子式为C10H14O,苯环上只有一个取代基且属于醇的同分异构体有( )
| A. | 10 | B. | 12 | C. | 11 | D. | 14 |
9.下列颜色变化与氧化还原反应无关的是( )
| A. | 将乙醛加入新制Cu(OH)2悬浊液中并加热至沸腾,出现红色沉淀 | |
| B. | 将乙醇滴入酸性K2Cr2O7溶液中,溶液由橙色变为绿色 | |
| C. | 将SO2通入滴有酚酞的NaOH溶液中,溶液红色褪去 | |
| D. | 新制氯水敞口处久置,颜色褪去 |
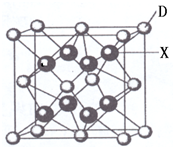 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC 2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层.AC 2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示).
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC 2的晶体为离子晶体,其阳离子与阴离子的个数比为1:1,D的二价阳离子比C的简单阴离子多一个电子层.AC 2为非极性分子.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E原子序数为26.回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示).