题目内容
6.将2.8g铁投入200mL某浓度的盐酸中,铁和盐酸恰好完全反应.求:(1)反应中生成的H2在标准状况下的体积;
(2)所用盐酸中HCl的物质的量浓度.
分析 设生成的氢气物质的量为x,反应消耗HCl的物质的量为y,
Fe+2HCl=FeCl2+H2↑
56g 2mol 1mol
2.8g y x,
分别列示计算出x、y,然后根据V=nVm计算出反应生成标准状况下氢气的体积及该元素的浓度.
解答 解:设生成的氢气物质的量为x,反应消耗HCl的物质的量为y,
Fe+2HCl=FeCl2+H2↑
56g 2mol 1mol
2.8g y x,
则:y=$\frac{2.8g×2mol}{56g}$=0.1mol,x=$\frac{2.8g×1mol}{56g}$=0.05mol,
(1)标准状况下0.05mol氢气在标准状况下的体积为:22.4L/mol×0.05mol=1.12L,
答:反应中生成的H2在标准状况下的体积为1.12L;
(2)该盐酸的物质的量浓度为:c(HCl)=$\frac{0.1mol}{0.2L}$=0.5mol/L,
答:该元素的浓度为0.5mol/L.
点评 本题考查了化学方程式的计算,题目难度中等,明确发生反应的原理为解答关键,注意熟练掌握物质的量与摩尔质量、气体摩尔体积的关系,试题培养了学生的化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
16.下列有关化学用语正确的是( )
| A. | 离子结构示意图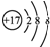 :可以表示35Cl-,也可以表示37Cl- :可以表示35Cl-,也可以表示37Cl- | |
| B. | 电子式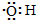 :可以表示羟基,也可以表示氢氧根离子 :可以表示羟基,也可以表示氢氧根离子 | |
| C. | 比例模型 :可以表示甲烷分子,也可以表示四氯化碳分子 :可以表示甲烷分子,也可以表示四氯化碳分子 | |
| D. | 聚丙烯的结构简式: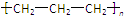 |
17.钒是一种重要的合金元素,还用于催化剂和新型电池.从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如图1:

部分含钒化合物在水中的溶解性如表:
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有VO2+和Al3+.
(2)反应②碱浸后滤出的固体主要成分是Al(OH)3(写化学式).
(3)反应④的离子方程式为VO3-+NH4+=NH4VO3↓.
(4)25℃、101 kPa时,4Al(s)+3O2(g)═2Al2O3(s)△H1=-a kJ/mol
4V(s)+5O2(g)═2V2O5(s)△H2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$kJ/mol.
(5)钒液流电池(如图2所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过.电池放电时负极的电极反应式为V2+-e-=V3+,电池充电时阳极的电极反应式是VO2+-e-+H2O=VO2++2H+.
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO${\;}_{2}^{+}$+H2C2O4+2H+═2VO2++2CO2↑+2H2O.取25.00mL0.1000 mol/L
H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0mL,由此可知,该(VO2)2SO4溶液中钒的含量为10.6g/L.

部分含钒化合物在水中的溶解性如表:
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
(1)反应①所得溶液中除H+之外的阳离子有VO2+和Al3+.
(2)反应②碱浸后滤出的固体主要成分是Al(OH)3(写化学式).
(3)反应④的离子方程式为VO3-+NH4+=NH4VO3↓.
(4)25℃、101 kPa时,4Al(s)+3O2(g)═2Al2O3(s)△H1=-a kJ/mol
4V(s)+5O2(g)═2V2O5(s)△H2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$kJ/mol.
(5)钒液流电池(如图2所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过.电池放电时负极的电极反应式为V2+-e-=V3+,电池充电时阳极的电极反应式是VO2+-e-+H2O=VO2++2H+.
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO${\;}_{2}^{+}$+H2C2O4+2H+═2VO2++2CO2↑+2H2O.取25.00mL0.1000 mol/L
H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0mL,由此可知,该(VO2)2SO4溶液中钒的含量为10.6g/L.
14.分子式为C10H14O,苯环上只有一个取代基且属于醇的同分异构体有( )
| A. | 10 | B. | 12 | C. | 11 | D. | 14 |
5.在K2Cr2O7溶液中存在平衡:Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)
(橙色) (黄色)
下列说法正确的是( )
(橙色) (黄色)
下列说法正确的是( )
| A. | 滴加硫酸酸化的FeSO4溶液,平衡不移动 | |
| B. | 溶液颜色保持不变时,该反应达到平衡状态 | |
| C. | 滴加6 mol/L NaOH溶液,溶液颜色变深 | |
| D. | 平衡常数表达式为K=$\frac{2c(Cr{{O}_{4}}^{2-})•2c({H}^{+})}{c(C{r}_{2}{{O}_{7}}^{2-})•c({H}_{2}O)}$ |
9.下列颜色变化与氧化还原反应无关的是( )
| A. | 将乙醛加入新制Cu(OH)2悬浊液中并加热至沸腾,出现红色沉淀 | |
| B. | 将乙醇滴入酸性K2Cr2O7溶液中,溶液由橙色变为绿色 | |
| C. | 将SO2通入滴有酚酞的NaOH溶液中,溶液红色褪去 | |
| D. | 新制氯水敞口处久置,颜色褪去 |
10.下列物质属于天然有机高分子化合物的是( )
| A. | 塑料 | B. | 油脂 | C. | 淀粉 | D. | 橡胶 |
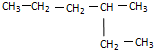 与
与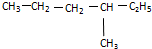 ⑨CS2
⑨CS2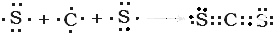 .
.