题目内容
根据下列热化学方程式:
①C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
②H2(g)+
O2(g)═H2O(l)△H2=-285.8kJ/mol
③CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为△H4= .
①C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
②H2(g)+
| 1 |
| 2 |
③CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为△H4=
考点:用盖斯定律进行有关反应热的计算
专题:化学反应中的能量变化
分析:依据热化学方程式和盖斯定律计算分析,反应的焓变与反应过程无关,只与起始状态和终了状态有关.
解答:
解:已知 ①C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
②H2(g)+
O2(g)═H2O(l)△H2=-285.8kJ/mol
③CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
依据盖斯定律(1)×2-(3)+(2)×2得到
2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=(-393.5kJ/mol)×2-(-870.3kJ/mol)+(-285.8kJ/mol)×2=-488.3 kJ/mol
故答案为:-488.3 kJ/mol.
②H2(g)+
| 1 |
| 2 |
③CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
依据盖斯定律(1)×2-(3)+(2)×2得到
2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=(-393.5kJ/mol)×2-(-870.3kJ/mol)+(-285.8kJ/mol)×2=-488.3 kJ/mol
故答案为:-488.3 kJ/mol.
点评:本题考查热化学方程式的书写和盖斯定律的计算应用,题目较简单.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目
铁镍蓄电池又称爱迪生电池,其充、放电按下式进行:Fe+Ni2O3+3H2O
Fe(OH)2+2Ni(OH)2,下列有关该电池的说法不正确的是( )
| 放电 |
| 充电 |
| A、电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B、电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
| C、电池充电过程中,阴极附近溶液的pH降低 |
| D、电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O |
一定温度和压强不变的条件下,发生可逆反应:A(g)+3B(g)?4C(g)下列叙述能作为该反应达到平衡状态的标志的是( )
①混合气体的平均摩尔质量不再变化
②v(A):v(B):v(C)=1:3:4
③A、B、C的浓度不再变化
④C的体积分数不再变化
⑤A、B、C的分子数之比为1:3:4
⑥混合气体的密度不再变化
⑦单位时间消耗amolA,同时生成3amolB.
①混合气体的平均摩尔质量不再变化
②v(A):v(B):v(C)=1:3:4
③A、B、C的浓度不再变化
④C的体积分数不再变化
⑤A、B、C的分子数之比为1:3:4
⑥混合气体的密度不再变化
⑦单位时间消耗amolA,同时生成3amolB.
| A、②③④⑤⑥⑦ | B、③④⑦ |
| C、②③④⑦ | D、①③⑤⑥⑦ |
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A、在0.1 mol?L-1 NaHCO3溶液中:c(CO3 2- )>c(H2CO3) |
| B、在0.1 mol?L-1 Na2CO3溶液中:c(OH- )=c(HCO3- )+c(H2CO3)+c(H+ ) |
| C、某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子,该溶液可能由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| D、c(NH4+)相等的(NH4)2SO4溶液、(NH4)2 Fe(SO4)2溶液和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2 Fe(SO4)2]<c[(NH4)2 SO4]<c(NH4Cl) |
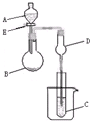 一个装置有多种用途是化学实验中经常出现的问题.用图所示装置进行实验,将A逐滴加入B中:
一个装置有多种用途是化学实验中经常出现的问题.用图所示装置进行实验,将A逐滴加入B中: