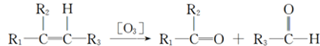��Ŀ����
Ϊ�˼���CO�Դ�������Ⱦ��ij�о���ѧϰС�����о�CO��H2O��Ӧת��Ϊ��ɫ��ԴH2����֪��
2CO��g��+O2��g��=2CO2��g����H=-566kJ?moL-1
2H2��g��+O2��g��=2H2O��g����H=-483.6kJ?moL-1
H2O��g��=H2O��l����H=-44.0kJ?moL-1
��1�������ı�ȼ���ȡ�H= kJ?moL-1��
��2��д��CO��H2O��g����������CO2��H2���Ȼ�ѧ����ʽ�� ��
��3��H2��һ���������ɫ��Դ������ȼ�ϵ�أ���������ȼ�ϵ����KOHΪ�������Һ���为���ĵ缫��Ӧʽ�� ��
2CO��g��+O2��g��=2CO2��g����H=-566kJ?moL-1
2H2��g��+O2��g��=2H2O��g����H=-483.6kJ?moL-1
H2O��g��=H2O��l����H=-44.0kJ?moL-1
��1�������ı�ȼ���ȡ�H=
��2��д��CO��H2O��g����������CO2��H2���Ȼ�ѧ����ʽ��
��3��H2��һ���������ɫ��Դ������ȼ�ϵ�أ���������ȼ�ϵ����KOHΪ�������Һ���为���ĵ缫��Ӧʽ��
���㣺�ø�˹���ɽ����йط�Ӧ�ȵļ���,��ѧ��Դ���͵��
ר�⣺��ѧ��Ӧ�е������仯,�绯ѧר��
��������1��ͨ�������£�1mol������ȫȼ������Һ̬ˮ�ų�������Ϊ������ȼ���ȣ����ø�˹���ɣ�������֪�Ȼ�ѧ����ʽ���Ժ��ʵ�ϵ��������Ӧ�Ӽ�����Ŀ���Ȼ�ѧ����ʽ����Ӧ��Ҳ������Ӧ��ϵ��������Ӧ�ļӼ����ݴ���д�жϣ�
��2�����ø�˹���ɣ�������֪�Ȼ�ѧ����ʽ���Ժ��ʵ�ϵ��������Ӧ�Ӽ�����Ŀ���Ȼ�ѧ����ʽ����Ӧ��Ҳ������Ӧ��ϵ��������Ӧ�ļӼ���
��3��ԭ��ظ�������������Ӧ�������ڸ����ŵ磬�ڼ��������£������ŵ�����ˮ��
��2�����ø�˹���ɣ�������֪�Ȼ�ѧ����ʽ���Ժ��ʵ�ϵ��������Ӧ�Ӽ�����Ŀ���Ȼ�ѧ����ʽ����Ӧ��Ҳ������Ӧ��ϵ��������Ӧ�ļӼ���
��3��ԭ��ظ�������������Ӧ�������ڸ����ŵ磬�ڼ��������£������ŵ�����ˮ��
���
�⣺��1����֪����2H2��g��+O2��g��=2H2O��g����H=-483.6KJ?moL-1
��H2O ��g��=H2O��l����H=-44.0KJ?moL-1
���ݸ�˹���ɣ��١�
+�ڵ�H2��g��+
O2��g��=H2O��l����H=
����-483.6KJ?moL-1��+��-44.0KJ?moL-1��=-285.8KJ?moL-1��
�ʴ�Ϊ��-285.8��
��2����֪����2CO��g��+O2��g��=2CO2��g����H=-566kJ?moL-1
��2H2��g��+O2��g��=2H2O��g����H=-483.6KJ?moL-1
���ݸ�˹���ɣ���-�ڵ�2CO��g��+2H2O��g��=2H2��g��+2CO2��g����H=-566kJ?moL-1-��-483.6KJ?moL-1��=-82.4KJ?moL-1��
��CO��g��+H2O��g��=H2��g��+CO2��g����H=-41.2KJ?moL-1��
�ʴ�Ϊ��CO��g��+H2O��g��=H2��g��+CO2��g����H=-41.2KJ?moL-1��
��3��ԭ��ظ�������������Ӧ�������ڸ����ŵ磬�ڼ��������£������ŵ�����ˮ��
�����缫��ӦʽΪH2-2e-+2OH-�T2H2O��
�ʴ�Ϊ��H2-2e-+2OH-�T2H2O��
��H2O ��g��=H2O��l����H=-44.0KJ?moL-1
���ݸ�˹���ɣ��١�
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
�ʴ�Ϊ��-285.8��
��2����֪����2CO��g��+O2��g��=2CO2��g����H=-566kJ?moL-1
��2H2��g��+O2��g��=2H2O��g����H=-483.6KJ?moL-1
���ݸ�˹���ɣ���-�ڵ�2CO��g��+2H2O��g��=2H2��g��+2CO2��g����H=-566kJ?moL-1-��-483.6KJ?moL-1��=-82.4KJ?moL-1��
��CO��g��+H2O��g��=H2��g��+CO2��g����H=-41.2KJ?moL-1��
�ʴ�Ϊ��CO��g��+H2O��g��=H2��g��+CO2��g����H=-41.2KJ?moL-1��
��3��ԭ��ظ�������������Ӧ�������ڸ����ŵ磬�ڼ��������£������ŵ�����ˮ��
�����缫��ӦʽΪH2-2e-+2OH-�T2H2O��
�ʴ�Ϊ��H2-2e-+2OH-�T2H2O��
����������ȼ���ȸ���Ȼ�ѧ����ʽ��д����㡢ԭ��صȣ��Ƕ�֪ʶ���ۺ�Ӧ�ã��Ѷ��еȣ�ע���������ȼ���ȵĸ��

��ϰ��ϵ�д�
 ��ѧȫ��������ѵ��ϵ�д�
��ѧȫ��������ѵ��ϵ�д�
�����Ŀ
��KCl��BaCl2�Ļ����ҺaL���ȷֳ����ݣ�������һ���еμ�ϡ���ᣬʹBa2+��ȫ����������һ���еμ�AgNO3��Һ��ʹCl-��ȫ��������Ӧ������xmolH2SO4��ymolAgNO3�������й��ƶ���ȷ���ǣ�������
| A��x=y |
| B��c��K+��=��2y-4x��/a mol?L-1 |
| C����ʵ����ʹ��98%�ܶ�Ϊ1.84g/cm3��������ϡ���ᣬ��Ҫ����������Ϊx/18.4mL |
| D����a L�����Һ��c��K+��=1 mol/L����y=0.4����x=�� 0.2-0.5a �� |
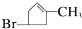
�Ҵ����ӽṹ�еĸ��ֻ�ѧ����ͼ��ʾ�����й����Ҵ��ڸ��ַ�Ӧ�жϼ���˵����ȷ���ǣ�������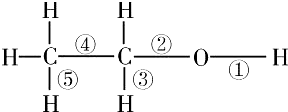

| A������ᡢŨ���Ṳ��ʱ���Ѣ� |
| B���ڿ�����ȼ��ʱ���Ѣܢ� |
| C���ͽ����Ʒ�Ӧʱ���Ѣ� |
| D����Cu���º�O2��Ӧʱ���Ѣڢ� |
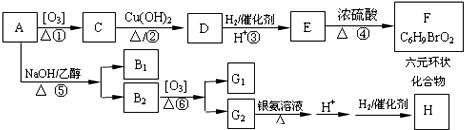
 ��������A��H��ת����ϵ��ͼ��ʾ��B1��B2��Ϊͬ���칹�壬B1��Ħ������80g/mol��G1��G2��Ϊͬ���칹�壬�˴Ź���������ʾ���߾�ֻ�������⣬G1����������������⣮
��������A��H��ת����ϵ��ͼ��ʾ��B1��B2��Ϊͬ���칹�壬B1��Ħ������80g/mol��G1��G2��Ϊͬ���칹�壬�˴Ź���������ʾ���߾�ֻ�������⣬G1����������������⣮