题目内容
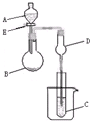 一个装置有多种用途是化学实验中经常出现的问题.用图所示装置进行实验,将A逐滴加入B中:
一个装置有多种用途是化学实验中经常出现的问题.用图所示装置进行实验,将A逐滴加入B中:(1)若A为浓H2SO4,B为第三周期金属元素的片状单质,其在常温下难与水反应;C为品红溶液,实验中观察到溶液褪色,则B是
(2)若B为Na2CO3,C为C6H5ONa溶液,实验中观察到小试管内溶液变浑浊,则酸A可以选用的试剂有
(3)若B是生石灰,实验中观察到C溶液先形成沉淀,然后沉淀溶解,当溶液恰好澄清时,关闭E,然后往烧杯中加入热水,静置片刻,观察到试管壁出现光亮的银镜,则A是
考点:实验装置综合
专题:实验题,元素及其化合物
分析:(1)由题意可知,B为第三周期金属元素的片状单质,其在常温下难与水反应,B可能为铝或镁,但浓硫酸常温下会使铝钝化,所以B只能为镁;
(2)根据较强酸的可制取较弱酸的原则,可推断出A的性质;
(3)由最后能发生银镜反应知,前面装置为氨水与生石灰制备氨气,结合乙醛的性质解答.
(2)根据较强酸的可制取较弱酸的原则,可推断出A的性质;
(3)由最后能发生银镜反应知,前面装置为氨水与生石灰制备氨气,结合乙醛的性质解答.
解答:
解:(1)由题意可知,B为第三周期金属元素的片状单质,其在常温下难与水反应,B可能为铝活着镁,但浓硫酸常温下会使铝钝化,所以B只能为镁,与浓硫酸发生氧化还原反应,反应的方程式为Mg+2H2SO4(浓)=MgSO4+SO2↑+2H2O,SO2具有漂白性,可使品红褪色;
故答案为:Mg;
(2)观察到小试管内溶液变浑浊,说明生成二氧化碳,则A的酸性应比碳酸的酸性强,生成苯酚易溶于热水,加热溶液变澄清,
故答案为:酸性比碳酸的酸性强;溶液由浑浊变澄清;
(3)试管壁出现光亮的银镜,C中应为乙醛与银氨溶液的反应,说明生成氨气,则AB装置中为浓氨水与生石灰混合制取氨气,氨气通入C中AgNO3和乙醛的混合液先与硝酸银形成银氨溶液,银氨溶液与乙醛发生银镜反应,氨气极易溶于水要防止倒吸,则装置D是防止倒吸的装置;
故答案为:浓氨水;AgNO3;防止倒吸.
故答案为:Mg;
(2)观察到小试管内溶液变浑浊,说明生成二氧化碳,则A的酸性应比碳酸的酸性强,生成苯酚易溶于热水,加热溶液变澄清,
故答案为:酸性比碳酸的酸性强;溶液由浑浊变澄清;
(3)试管壁出现光亮的银镜,C中应为乙醛与银氨溶液的反应,说明生成氨气,则AB装置中为浓氨水与生石灰混合制取氨气,氨气通入C中AgNO3和乙醛的混合液先与硝酸银形成银氨溶液,银氨溶液与乙醛发生银镜反应,氨气极易溶于水要防止倒吸,则装置D是防止倒吸的装置;
故答案为:浓氨水;AgNO3;防止倒吸.
点评:本题为一实验综合题,考查了常见重要的无机和有机实验,侧重于考查学生的实验基本操作能力和实验探究能力,题目难度中等,注意把握乙醛与银氨溶液的反应、以及银氨溶液的制备方法.

练习册系列答案
相关题目
将KCl和BaCl2的混合溶液aL均匀分成两份.向其中一份中滴加稀硫酸,使Ba2+完全沉淀;向另一份中滴加AgNO3溶液,使Cl-完全沉淀.反应中消耗xmolH2SO4、ymolAgNO3.下列有关推断正确的是( )
| A、x=y |
| B、c(K+)=(2y-4x)/a mol?L-1 |
| C、若实验中使用98%密度为1.84g/cm3硫酸配制稀硫酸,需要该硫酸的体积为x/18.4mL |
| D、若a L混合溶液中c(K+)=1 mol/L,且y=0.4,则x=( 0.2-0.5a ) |
乙醇分子结构中的各种化学键如图所示,下列关于乙醇在各种反应中断键的说法正确的是( )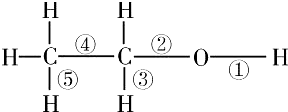

| A、与醋酸、浓硫酸共热时断裂① |
| B、在空气中燃烧时断裂④⑤ |
| C、和金属钠反应时断裂② |
| D、在Cu催化下和O2反应时断裂②③ |
下列说法中,错误的是( )
| A、无论乙烯与Br2的加成,还是乙烯使酸性KMnO4溶液褪色,都与分子内碳碳双键有关 |
| B、用溴的四氯化碳溶液或酸性KMnO4溶液都可以鉴别乙烯和乙烷 |
| C、相同质量的乙烯和甲烷完全燃烧后产生的水的质量相同 |
| D、乙烯与乙炔都能使溴水褪色,且原理相同 |
下列各组离子在通入SO2前后均能大量共存的是( )
| A、Ba2+、K+、Br-、Cl- |
| B、Na+、Cu2+、OH-、SiO32- |
| C、NH4+、Al3+、Br-、AlO2- |
| D、Li+、H+、NO3-、SO42- |
下列说法正确的是( )
| A、酸式盐的水溶液一定显酸性 |
| B、酸性氧化物一定是非金属氧化物 |
| C、丁达尔效应是溶液和胶体的本质区别 |
| D、HClO是弱酸,但NaClO是强电解质 |
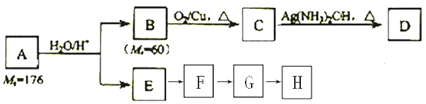 ,其中H为
,其中H为 ,
,