题目内容
15.具有下列特点的物质中,属于纯净物的是( )| A. | 由同种元素组成 | B. | 不能发生分解反应 | ||
| C. | 具有固定的熔沸点 | D. | 物质能溶于水 |
分析 A.同种元素组成的不同单质为同素异形体;
B.混合物有的也不发生分解反应;
C.纯净物是一种物质组成具有固定的熔沸点;
D.混合物也可以溶于水;
解答 解:A.O2、O3是同种元素组成的不同单质,二者混合为混合物,故A错误;
B.氧气、氮气混合气体不分解,属于混合物,不分解的不一定为纯净物,故B错误;
C.具有固定的熔沸点,说明是一种物质组成属于纯净物,故C正确;
D.混合物也可以溶于水,如氯化钠和硝酸钾的混合物溶于水,故D错误;
故选C.
点评 本题考查了物质分类、物质组成的特征分析,主要是纯净物和混合物的区别性质判断,题目难度中等.

练习册系列答案
 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
5.下列实验中,为实现实验目的,除杂操作正确的是( )
| 实验 | 除杂试剂 | 实验目的 | |
| ① | 电石与水反应 | CuSO4溶液 | 用KMnO4酸性溶液检验乙炔的还原性 |
| ② | CH3CH2Br与NaOH溶液共热 | HNO3溶液 | 用AgNO3溶液检验CH3CH2Br中的Br |
| ③ | 淀粉与稀H2SO4水浴共热 | NaOH溶液 | 用银氨溶液检验水解产物的还原性 |
| ④ | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | 用Br2的CCl4溶液证明该反应为消去反应 |
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①②③④ |
10.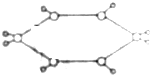 已知某烃的球棍模型如图所示,图中“-”代表单键或双键,则下列有关烃的说法中正确的是( )
已知某烃的球棍模型如图所示,图中“-”代表单键或双键,则下列有关烃的说法中正确的是( )
 已知某烃的球棍模型如图所示,图中“-”代表单键或双键,则下列有关烃的说法中正确的是( )
已知某烃的球棍模型如图所示,图中“-”代表单键或双键,则下列有关烃的说法中正确的是( )| A. | 属于芳香烃 | B. | 常温常压下为气体 | ||
| C. | 该烃的一氯代物有四种 | D. | 能使溴的四氯化碳溶液褪色 |
20.检验Na2SO3是否被氧化,所选用的试剂应为( )
| A. | 氯化钡 | B. | 盐酸 | C. | 氯化钡和盐酸 | D. | 氯化钡和硫酸 |
7.甲醇和正丙醇是两种常见的液态有机物,它们的某些物理性质如下表所示.据此,请判断将甲醇和正丙醇的混合物进行分离的最佳方法是( )
| 物质 | 熔点 | 沸点 | 密度 | 溶解性 |
| 甲醇 | -97.8℃ | 64.8℃ | 0.791g•mL-1 | 易溶于水、乙醇、正丙醇 |
| 正丙醇 | -126.5℃ | 97.4℃ | 0.804g•mL-1 | 能跟水、甲醇、乙醇以任意比互溶 |
| A. | 萃取 | B. | 过滤 | C. | 蒸发 | D. | 蒸馏 |
17.下列有关化学键的叙述,正确是的( )
| A. | 共价化合物中可以含有离子键 | |
| B. | 单质分子中均不存在化学键 | |
| C. | 含活泼金属元素的化合物可能是共价化合物 | |
| D. | 含有共价键的化合物一定是共价化合物 |
18.下列关于化学反应速率的叙述不正确的是( )
| A. | 食物放在冰箱中会减慢变质的速率 | |
| B. | 实验室制备CO2时,可通过增加石灰石的用量来加快反应速率 | |
| C. | 工业合成中使用适当的催化剂为了加快反应速率 | |
| D. | 实验室用锌和稀硫酸制取H2时,常滴加少量硫酸铜溶液加快反应的速率 |
 .
. .
.