题目内容
6.物质的结构决定物质的性质.请回答下列涉及物质结构和性质的问题:(1)基态Cu2+的电子排布式为1s22s22p63s23p63d9,其M电子层的电子数为17.
(2)VSEPR理论认为价层电子对间互斥力(F)大小顺序:F(孤电子对间)>F(孤电子对-成键电子对)>F(成键电子对间),已知XeF4中Xe价层电子对数为6,其VSEPR模型为八面体,为使得价层电子对间的孤电子对斥力最小,预测XeF4分子中的键角应为90°.
(3)除NH3、H2O、HF外,同主族氢化物的沸点随周期数增大而升高的原因是同为分子晶体,物质的组成与结构相似,相对分子质量越大,分子间作用力越大,沸点越高;
已知NH3、H2O、HF的氢键键能和结构如表:
| 物质 | 氢键X-H…Y | 键能/kJ•mol-1 |
| (HF)n | F-H…F | 28.1 |
| 冰 | O-H…O | 18.8 |
| (NH3)n | N-H…N | 5.4 |
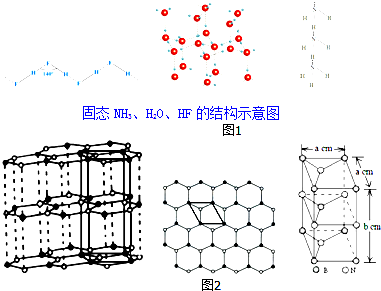
(4)石墨型BN呈白色,亦称“白石墨”.“白石墨”的结构示意图和晶胞如图2(中图是晶胞底面从“白石墨”中的截取情况),则“白石墨”中B和N的杂化方式分别为sp2和sp2,白石墨的密度为$\frac{100}{\sqrt{3}{N}_{A}{a}^{2}b}$g•cm-3( 已知相对原子质量B:11 N:14 阿伏加德罗常数的数值用NA表示).
分析 (1)根据Cu的电子排布式书写Cu2+离子的电子排布式,注意原子形成离子先失去高能层中高能级电子,并可据此判断其M电子层的电子数;
(2)使得价层电子对间的孤电子对斥力最小,则孤电子对应处于相对的位置,则XeF4分子中四个成键电子对处于同一平面上,据此判断;
(3)同主族氢化物一般都是分子晶体,除NH3、H2O、HF外,分子的相对分子质量越大,分子间的作用力越大,所以其沸点随周期数增大而升高,在NH3、H2O、HF中,氨分子只有一对孤电子对,氟化氢分子只有一个氢原子,水分子有两个氢原子和两对孤电子对,所以每摩尔氨气和氟化氢中都有1mol氢键,而每摩尔水中有2mol氢键,所以每摩尔水中含有氢键的键能为18.8kJ•mol-1×2=37.6kJ•mol-1,每摩尔NH3中含有氢键的键能为5.4kJ•mol-1,每摩尔HF中含有氢键的键能为28.1kJ•mol-1,每摩尔物所含氢键键能越大,即分子间作用力越大,则沸点越高,据此判断;
(4)根据石墨型BN的晶体结构可知,每个B原子周围有3个σ键、没有孤电子,N原子周围有3个σ键,没有孤电子,据此判断杂化方式,在BN晶胞中含有原子数共为$4×\frac{1}{12}+4×\frac{1}{6}+2×\frac{1}{3}+2×\frac{1}{6}+1+1$=10,其中半是B原子,一半是N原子,由于晶胞的下底面为内角为60°的棱形,所以晶胞的体积为$\frac{\sqrt{3}}{2}$a2b,根据$ρ=\frac{m}{V}$计算密度;
解答 解:(1)Cu是29号元素,原子核外电子数为29,Cu2+离子的电子排布式为:1s22s22p63s23p63d9,其M电子层的电子数为17,
故答案为:1s22s22p63s23p63d9;17;
(2)使得价层电子对间的孤电子对斥力最小,则孤电子对应处于相对的位置,则XeF4分子中四个成键电子对处于同一平面上,所以XeF4分子中的键角应为90°,
故答案为:90°;
(3)同主族氢化物一般都是分子晶体,除NH3、H2O、HF外,分子的相对分子质量越大,分子间的作用力越大,所以其沸点随周期数增大而升高,在NH3、H2O、HF中,氨分子只有一对孤电子对,氟化氢分子只有一个氢原子,水分子有两个氢原子和两对孤电子对,所以每摩尔氨气和氟化氢中都有1mol氢键,而每摩尔水中有2mol氢键,所以每摩尔水中含有氢键的键能为18.8kJ•mol-1×2=37.6kJ•mol-1,每摩尔NH3中含有氢键的键能为5.4kJ•mol-1,每摩尔HF中含有氢键的键能为28.1kJ•mol-1,每摩尔物所含氢键键能越大,即分子间作用力越大,则沸点越高,所以H2O、HF、NH3沸点由高到低的顺序依次为H2O>HF>NH3,
故答案为:同为分子晶体,物质的组成与结构相似,相对分子质量越大,分子间作用力越大,沸点越高;H2O>HF>NH3;
(4)根据石墨型BN的晶体结构可知,每个B原子周围有3个σ键、没有孤电子,所以B原子按sp2杂化,N原子周围有3个σ键,没有孤电子,所以N原子按sp2杂化,在BN晶胞中含有原子数共为$4×\frac{1}{12}+4×\frac{1}{6}+2×\frac{1}{3}+2×\frac{1}{6}+1+1$=10,其中半是B原子,一半是N原子,由于晶胞的下底面为内角为60°的棱形,所以晶胞的体积为$\frac{\sqrt{3}}{2}$a2b,根据$ρ=\frac{m}{V}$可知,其密度为$\frac{\frac{5×(11+14)}{{N}_{A}}}{\frac{\sqrt{3}}{2}{a}^{2b}}$g•cm-3=$\frac{100}{\sqrt{3}{N}_{A}{a}^{2}b}$g•cm-3,
故答案为:sp2和 sp2;$\frac{100}{\sqrt{3}{N}_{A}{a}^{2}b}$.
点评 本题考查核外电子排布、氢键、晶胞结构、性质等知识的应用,题目综合性较强,晶胞的结构分析和计算是难点,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 双键、三键中一定含有π键 | |
| B. | 成键原子间原子轨道重叠越多,共价键越牢固 | |
| C. | 因每个原子未成对电子数是一定的,故配对原子个数也一定 | |
| D. | 每一个原子轨道在空间都具有方向性 |
| A. | 稳定性:HF>HCl>HBr>HI | B. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | ||
| C. | 酸性:H2SO4>H3PO4>HClO4 | D. | 氧化性:O2>S>Se |
| A. | 常温常压下,18g重水(D2O)中所含的电子数为10 NA | |
| B. | 标准状况下,14g氮气含有的核外电子数为5NA | |
| C. | 标准状况下,22.4L氢气和氯气的混合气体中含有的分子总数为NA | |
| D. | 标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移电子数为NA |
| A. | 2和19 | B. | 6与8 | C. | 8与11 | D. | 9与9 |
| A. | 硅胶可作袋装食品的干燥剂 | |
| B. | 用活性炭可除去冰箱中的异味 | |
| C. | CO2、NO2、或SO2都会导致酸雨的形成 | |
| D. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 |
| A. | 煤的干馏 | |
| B. | 石油裂解 | |
| C. | 煤焦油经分馏得到苯、甲苯、二甲苯等 | |
| D. | 蛋白质的变性 |
实验一:取第一块铝片,直接放入硫酸铜溶液中观察现象
实验二:取第二块铝片,用砂纸擦试表面后,放入硫酸铜溶液中观察现象
实验三:将实验一中铝片从硫酸铜溶液中取出,洗净后放入氢氧化钠溶液中,片刻后取出铝片,洗净后再放入硫酸铜溶液中观察现象
实验四:取第三块铝片,用砂纸擦试表面后,置于浓硝酸中,片刻后取出,洗净,再放入硫酸铜溶液中观察现象
综合以上四个实验的主要目的是试图说明( )
| A. | 铝片能和硫酸铜溶液反应 | |
| B. | 铝片能和氢氧化钠溶液反应 | |
| C. | 铝片不能和硝酸反应 | |
| D. | 铝片表面能形成具有保护作用的氧化膜 |