题目内容
15.合成具有美白作用的化妆品原料Z的反应原理如下: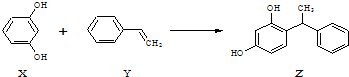
下列叙述不正确的是( )
| A. | X、Z均能与Na2CO3溶液反应 | |
| B. | X可作缩聚反应单体,Y可作加聚反应单体 | |
| C. | X、Y、Z均能使溴水褪色,但是原理不相同 | |
| D. | 该反应的反应类型为取代反应 |
分析 A.X和Z中都含有酚羟基,酚羟基和碳酸钠反应;
B.Y中含有碳碳双键,能发生加聚反应;X中含有酚羟基,能发生缩聚反应.
C.能和溴反应的有碳碳不饱和键、苯环上酚羟基邻对位氢原子;
D.该反应为加成反应.
解答 解:A.X和Z中都含有酚羟基,酚羟基和碳酸钠反应,所以二者能与碳酸钠反应,故A正确;
B.Y中含有碳碳双键,能发生加成反应;X中含有酚羟基,能发生缩聚反应,所以Y可作加聚反应单体,X可作缩聚反应单体,故B正确;
C.能和溴反应的有碳碳不饱和键、苯环上酚羟基邻对位氢原子,X、Z中都含有酚羟基且苯环上酚羟基邻对位有H原子,所以能发生取代反应而褪色;Y中含有碳碳双键,能与溴发生加成反应而褪色,故C正确;
D.该反应碳碳双键断裂,为加氢反应,即为加成反应,故D错误;
故选D.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查烯烃、酚的性质,注意:只有苯环上酚羟基的H原子易发生取代反应.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
6.依据图判断,下列说法正确的是( )
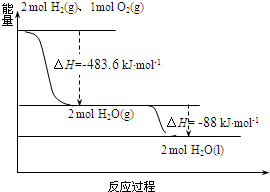

| A. | 2 mol H2(g)与1 mol O2(g)所具有的总能量比2 mol H2O(g) 所具有的总能量高 | |
| B. | 氢气燃烧的反应为放热反应,故H2与O2混合即可自发进行 | |
| C. | 液态水分解的热化学方程式为:2H2O(l)═2H2(g)+O2(g)△H=-571.6 kJ•mol-1 | |
| D. | H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量 |
10.在下列条件下,一定能大量共存的离子组是( )
| A. | 与Al产生H2的溶液中:Cl-、Na+、NO3- | |
| B. | 在某酸性透明的溶液中:Fe2+、H+、I- | |
| C. | 滴加KCSN试剂呈红色的溶液中:K+、SO32-、HCO3- | |
| D. | 在由水电离出的c(H+)×c(OH-)=1×10-24的溶液中:SO42-、F-、Na+ |
20.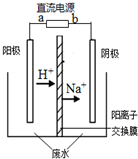 最近有研究人员利用隔膜电解法处理高浓度的乙醛废水.乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法不正确的是( )
最近有研究人员利用隔膜电解法处理高浓度的乙醛废水.乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法不正确的是( )
 最近有研究人员利用隔膜电解法处理高浓度的乙醛废水.乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法不正确的是( )
最近有研究人员利用隔膜电解法处理高浓度的乙醛废水.乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸.实验室以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示.下列说法不正确的是( )| A. | 电解过程中,阳极附近的乙醛被氧化 | |
| B. | 阳极反应CH3CHO-2e-+H2O═CH3COOH+2H+ | |
| C. | 若以CH4-空气燃料电池为直流电源,燃料电池的b极应通入CH4 | |
| D. | 现处理含1mol乙醛的废水,至少需转移2mol电子 |
7.下列说法不正确的是( )
| A. | 高纯度二氧化硅广泛用于制作光导纤维,其遇强碱会“断路” | |
| B. | 家用“84”消毒液可用来漂白衣物,为了增强漂白效果,可加入浓盐酸 | |
| C. | 浸泡过高锰酸钾溶液的硅藻土可以吸收乙烯,所以可用来保鲜水果 | |
| D. | 加热能杀死甲型 H1N1流感病毒是因为蛋白质受热变性 |
4.设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 22.4LO3中含3NA个氧原子 | |
| B. | 标准状况下,22.4LCH2Cl2含有2NA氯原子 | |
| C. | 1molSO2与足量的H2S充分反应,转移NA个电子 | |
| D. | 16gCH4中含有10NA个质子 |
1.中国药学家屠呦呦荣获2015年诺贝尔生理学或医学奖,以表彰她发现了一种药物-青蒿素,青蒿琥酯是治疗疟疾的首选药,可由青蒿素经两步合成得到.下列有关说法不正确的是( )
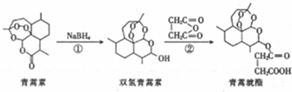

| A. | 青蒿素遇湿润的淀粉碘化钾试纸立刻变成紫色,是因为分子结构中含有过氧键 | |
| B. | 反应①属于还原反应,反应②的原子利用率为100% | |
| C. | 双氢青蒿素的苯溶液能与金属钠反应放出氢气 | |
| D. | 青蒿素和青蒿琥酯均能与碳酸氢钠溶液反应生成二氧化碳气体 |
 .
.