题目内容
6.将75mL的CH4、H2、CO混合后与200mL O2混合点燃,经充分反应并干燥,总体积减小100mL,再将剩余气体通过碱溶液,还剩125mL气体.(上述体积均在相同条件下测定)(1)混合气体能完全燃烧.(填“能”或“不能”)
(2)总体积减小100mL后,所得气体是CO2和O2,其体积是175mL.
(3)共生成CO250 mL,最后剩余的125mL气体是O2.
(4)原混合气中有CH425 mL,H225 mL,CO25 mL.
分析 75mL气体全部是甲烷时,消耗氧气最多为75mL×(1+$\frac{4}{4}$)=150mL<200mL,故氧气有剩余,发生反应:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O,2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,充分反应并干燥,总体积减小100mL,则剩余氧气与生成二氧化碳总体积为200mL+75mL-100mL=175mL,再将剩余气体通过碱溶液,还剩125mL气体,二氧化碳被吸收,则剩余氧气为125mL,燃烧生成二氧化碳为50mL,结合方程式列方程计算原混合气体中CH4、H2、CO 的体积.
解答 解:(1)75mL气体全部是甲烷时,消耗氧气最多为75mL×(1+$\frac{4}{4}$)=150mL<200mL,故氧气有剩余,混合气体完全燃烧,
故答案为:能;
(2)发生反应:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O,2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,充分反应并干燥,总体积减小100mL,则剩余氧气与生成二氧化碳总体积为200mL+75mL-100mL=175mL,
故答案为:CO2和O2;175mL;
(3)再将剩余气体通过碱溶液,还剩125mL气体,二氧化碳被吸收,则剩余氧气为125mL,燃烧生成二氧化碳为175mL-125mL=50mL,
故答案为:50;O2;
(4)设原混合气体中CH4、H2、CO 的体积分别为x mL、y mL、z mL,则:
CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O,
xmlL 2xmL xmL
2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,
ymL 0.5ymL
2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,
zmL 0.5zmL z mL
所以:x+y+z=75
2x+0.5y+0.5z=200-125
x+z=50
联立方程解得:x=y=z=25
故答案为:25;25;25.
点评 本题考查混合物反应有关计算,关键是利用极限法判断混合物能否完全燃烧,侧重考查学生分解计算能力.

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案| A. | 1:1 | B. | 2:1 | C. | 4:1 | D. | 无法确定 |
| A. | a-3-b | B. | b-3-a | C. | a+3-b | D. | a-3+b |
| A. | 甲>乙>丙>丁 | B. | 乙>甲>丙>丁 | C. | 丁>丙>乙>甲 | D. | 乙>甲>丁>丙 |
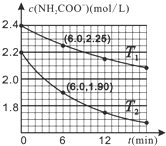 已知:NH2COO-+2H2O═HCO3-+NH3˙H2O.现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示.以下分析正确的是( )
已知:NH2COO-+2H2O═HCO3-+NH3˙H2O.现用两份氨基甲酸铵溶液在不同温度(T1和T2)下实验,得到c(NH2COO-)随时间变化关系如图所示.以下分析正确的是( )| A. | 无法判断T1和T2的大小关系 | |
| B. | T1℃时,第6min反应物转化率为6.25% | |
| C. | T2℃时,0~6min ν(NH2COO-)=0.3mol•L-1•min-1 | |
| D. | 往平衡体系加水稀释,平衡右移,溶液中各种离子浓度减小 |
| A. | 原子半径 Cl>Si>Na | B. | 金属性 Na>Mg>Al | ||
| C. | 碱性 LiOH>NaOH>KOH | D. | 酸性 H3PO4>H2SO4>HClO4 |
 ;②C物质苯环上一卤代物只有两种.
;②C物质苯环上一卤代物只有两种.
 ,F的分子式C9H10.
,F的分子式C9H10.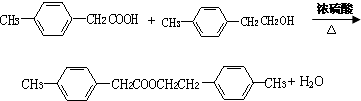 .
.