题目内容
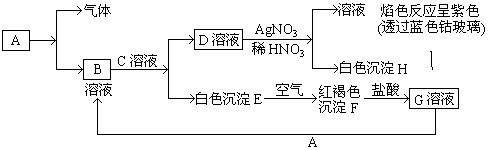
15.下列溶液一定不会出现沉淀的是( )| A. | SO2通入CaCl2溶液 | B. | H2S通入CuSO4溶液 | ||
| C. | SO2通入Ca(OH)2溶液 | D. | H2S通入FeSO4溶液 |
分析 A.亚硫酸的酸性比盐酸弱;
B.可生成硫化铜沉淀;
C.可生成亚硫酸钙沉淀;
D.二者不反应.
解答 解:A.二氧化硫和水反应生成亚硫酸,但亚硫酸的酸性比盐酸弱,所以二者不反应,没有沉淀生成,故A选;
B.因硫化铜不溶于硫酸,则可生成硫化铜沉淀,故B不选;
C.二者反应可生成亚硫酸钙沉淀,故C不选;
D.硫化亚铁可溶于硫酸,则硫化氢与硫酸亚铁不反应,故D选.
故选AD.
点评 本题综合考查元素化合物知识,为高频考点,侧重考查二氧化硫、硫化氢的知识,易错点为D,注意CuS、FeS的性质的区别,难度不大.

练习册系列答案
相关题目
1.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下,17g NH3所含的电子数是 10NA | |
| B. | 常温常压下,22.4L氧气含氧原子数为2NA | |
| C. | 0.5 mol/L K2SO4溶液中含有NA个K+离子 | |
| D. | 2.3g金属钠与氧气反应全部生成Na2O时失去的电子数是0.2NA |
2.化学实验中常将溶液或试剂进行酸化,下列酸化处理正确的是( )
| A. | 检验溶液中是否含有Fe2+时,所用KMnO4溶液用硫酸酸化 | |
| B. | 检验溶液中是否含有Br-时,所用AgNO3溶液用盐酸酸化 | |
| C. | 检验溶液中是否含有SO32-时,所用BaCl2溶液用硝酸酸化 | |
| D. | 检验溶液中是否含有SO42-时,所用BaCl2溶液用硝酸酸化 |
3.下列制备有关化学物质的工艺不可行的是( )
| A. | 提取食盐后的母液$\stackrel{石灰乳}{→}$Mg(OH)2$\stackrel{稀HCl}{→}$MgCl2溶液$\stackrel{电解}{→}$Mg | |
| B. | Cu$\stackrel{H_{2}O_{2},稀H_{2}SO_{4}}{→}$CuSO4溶液$\stackrel{蒸发,结晶}{→}$CuSO4•5H2O | |
| C. | 饱和食盐水$\stackrel{NH_{3}}{→}$$\stackrel{CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| D. | N2$→_{催化剂}^{H_{2}}$NH3$→_{催化剂}^{O_{2}}$NO→NO2$\stackrel{H_{2}O}{→}$HNO3 |
20.下列金属冶炼的反应原理,错误的是( )
| A. | MgO+H2 $\frac{\underline{\;\;△\;\;}}{\;}$Mg+H2O | B. | 2NaCl(熔融) $\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑ | ||
| C. | Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 | D. | 2HgO $\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ |
7.下列说正确的是( )
| A. | 物质的量就是1摩尔物质的质量 | B. | 1 mol水中含有2 mol氢和1 mol氧 | ||
| C. | 1 molH2中含有6.02个氢分子 | D. | NH3的摩尔质量是17g•mol-1 |
4.向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色.再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色.则下列分析中正确的是( )
| A. | 白色沉淀是CuI2,棕色溶液含有I2 | |
| B. | 滴加KI溶液时,转移1mol电子时生成0.5mol白色沉淀 | |
| C. | 通入SO2时,SO2与I2反应,I2作还原剂 | |
| D. | 上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
 氧化还原是常见的反应类型,根据信息回答以下问题:
氧化还原是常见的反应类型,根据信息回答以下问题: