题目内容
5.已知A为金属单质,下列物质相互转化如图所示:
试回答:
(1)写出B的化学式FeCl2D的化学式KCl.
(2)写出由E转变成F的化学方程式4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(3)检验G溶液中阳离子的试剂为KSCN写出发生反应的离子方程式Fe3++3SCN-=Fe(SCN)3;
(4)向G溶液加入A的有关离子反应方程式2Fe3++Fe=3Fe2+.
(5)某同学取B的溶液酸化后加入碘化钾淀粉溶液,在空气中放置一会儿变为蓝色,写出与上述变化过程相关的离子方程式4Fe2++O2+4H+═4Fe3++2H2O,2Fe3++2I-═2Fe2++I2.
分析 白色沉淀E在空气中变化为红褐色沉淀F,说明E为Fe(OH)2,F为Fe(OH)3,F与盐酸反应生成G为FeCl3,金属A与氯化铁反应生成B,B与C反应得到E与D,故A为Fe,B为FeCl2,则Fe与盐酸反应生成氢气与氯化亚铁;D溶液和硝酸酸化的硝酸银反应生成白色沉淀H为AgCl,溶液透过钴玻璃进行焰色反应为紫色,证明溶液中含有钾元素,故D为KCl,则C为KOH,据此进行解答.
解答 解:(1)根据以上分析,B的化学式为FeCl2,D的化学式为KCl,故答案为:FeCl2;KCl;
(2)由E转变成F是氢氧化亚铁被氧化为氢氧化铁,反应的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)用KSCN鉴别G(FeCl3)溶液中三价铁离子,反应的离子方程式为:Fe3++3SCN-=Fe(SCN)3;
故答案为:KSCN;Fe3++3SCN-=Fe(SCN)3;
(4)G为FeCl3,A为Fe,则向G溶液加入A的有关离子反应方程式2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
(5)B为FeCl2,取B的溶液酸化后加入碘化钾淀粉溶液,在空气中放置一会儿变为蓝色,则亚铁离子被氧气氧化为铁离子,铁离子氧化碘离子生成碘单质,碘遇淀粉变为蓝色,反应涉及的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O、2Fe3++2I-═2Fe2++I2,
故答案为:4Fe2++O2+4H+═4Fe3++2H2O、2Fe3++2I-═2Fe2++I2.
点评 本题以无机框图题的形式,考查Fe、Cl等元素单质及其化合物之间的相互转化关系,本题中白色沉淀转化为红褐色沉淀,溶液K焰色反应为紫色等解题突破口,难度中等.

| A. | SO2通入CaCl2溶液 | B. | H2S通入CuSO4溶液 | ||
| C. | SO2通入Ca(OH)2溶液 | D. | H2S通入FeSO4溶液 |
| A. | 氨水 | B. | 氯水 | C. | 食盐水 | D. | 蒸馏水 |
| A. | 氯气作自来水的杀菌消毒剂 | B. | 硅胶作袋装食品的干燥剂 | ||
| C. | 二氧化硫作纸浆的漂白剂 | D. | 大气中的NO2导致酸雨的形成 |
| 实验操作 | 实验现象 | 结论 | |
| A | 向硅酸钠溶液中滴加1滴酚酞,再逐滴加入稀盐酸至红色褪去 | 试管里出现白色沉淀 | 酸性:盐酸>硅酸 |
| B | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点:氧化铝>铝 |
| C | 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 该溶液中一定含有SO42- |
| D | 向某无色溶液中先滴加氯水,再加少量CCl4,振荡,静置 | 溶液分层,下层为橙红色 | 溶液中含有Br- |
| A. | A | B. | B | C. | C | D. | D |
| A. | 苯与浓硝酸、浓硫酸共热并保持50~60℃反应生成硝基苯 | |
| B. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于苯环对侧链的影响,使侧链易被氧化 | |
| C. | 若甲苯苯环上的一个氢原子被一个含3个碳原子的烷基取代,所得产物有6种 | |
| D. | 菲的结构简式为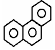 ,它与硝酸反应,可生成3种一硝基取代物 ,它与硝酸反应,可生成3种一硝基取代物 |
| A. | 0.1 mol•L-1Na2S溶液与0.1 mol•L-1NaHS溶液等体积混合:2c(H2S)═3c(Na+)-2c(HS-)-2c(S2-) | |
| B. | 0.1 mol•L-1氨水与0.05 mol•L-1盐酸等体积混合:c(OH-)+c (NH3•H2O)═c(Cl-)+c(H+) | |
| C. | pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合:c(CH3COOH)+c(H+)>c(OH-)+c(Na+) | |
| D. | 浓度均为0.1 mol•L-1的NH4HSO4溶液与NaOH溶液等体积混合:c(Na+)=c(SO${\;}_{4}^{2-}$)>c(NH${\;}_{4}^{+}$)>c(OH-)>c(H+) |
