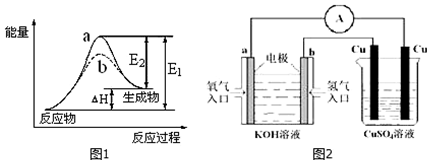
题目内容
20.下列金属冶炼的反应原理,错误的是( )| A. | MgO+H2 $\frac{\underline{\;\;△\;\;}}{\;}$Mg+H2O | B. | 2NaCl(熔融) $\frac{\underline{\;通电\;}}{\;}$2Na+Cl2↑ | ||
| C. | Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 | D. | 2HgO $\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ |
分析 金属冶炼是工业上将金属从含有金属元素的矿石中还原出来的生产过程.金属的活动性不同,可以采用不同的冶炼方法.
金属冶炼的方法主要有:热分解法:对于不活泼金属,可以直接用加热分解的方法将金属从其化合物中还原出来(Hg及后边金属);
热还原法:在金属活动性顺序表中处于中间位置的金属,通常是用还原剂(C、CO、H2、活泼金属等)将金属从其化合物中还原出来(Zn~Cu);
电解法:活泼金属较难用还原剂还原,通常采用电解熔融的金属化合物的方法冶炼活泼金属(K~Al).
解答 解:A、金属镁是活泼金属,工业上采用电解熔融氯化镁的方法冶炼,故A错误;
B、金属钠是活泼金属,工业上采用电解熔融物的方法冶炼,故B正确;
C、工业上采用热还原法来冶炼金属铁,故C正确;
D、对于不活泼金属Hg,可以直接用加热分解的方法将金属从氧化汞中还原出来,故D正确.
故选A.
点评 本题考查了金属冶炼的一般原理,难度不大,注意根据金属的活泼性不同采取相应的冶炼方法.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
6.对图两种化合物的结构或性质描述正确的是( )
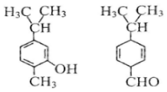

| A. | 不是同分异构体 | |
| B. | 分子中共平面的碳原了数相同 | |
| C. | 含氧官能团的性质不同 | |
| D. | 可用红外光谱区分,但不能用核磁共振氢谱区分 |
7.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液.下列对此现象说法正确的是( )
| A. | 向反应后的深蓝色溶液中加入乙醇,会有蓝色的CuSO4•5H2O晶体析出 | |
| B. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 | |
| C. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的数目不变 | |
| D. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ |
8.实现下列变化时,必须克服相同类型作用的是( )
| A. | 二氧化硅和冰的熔化 | B. | 氯化钠和铁的熔化 | ||
| C. | 烧碱和金刚石的熔化 | D. | 碘和干冰的升华 |
15.下列溶液一定不会出现沉淀的是( )
| A. | SO2通入CaCl2溶液 | B. | H2S通入CuSO4溶液 | ||
| C. | SO2通入Ca(OH)2溶液 | D. | H2S通入FeSO4溶液 |
12.某溶液中加入铝粉有氢气产生,该溶液中肯定可以大量共存的离子组是( )
| A. | Na+NO3-CO32- Cl- | B. | HCO3-Ba2+ Na+ K+ | ||
| C. | Cl- Na+ K+ SO42- | D. | K+Fe2+SO42- Cl- |
9.下列分子中,具有极性共价键的非极性分子的是( )
| A. | l2 | B. | NH3(三角锥型) | C. | CO2 | D. | SO2(键角120°) |
10.下列有关说法不正确的是( )
| A. | 苯与浓硝酸、浓硫酸共热并保持50~60℃反应生成硝基苯 | |
| B. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于苯环对侧链的影响,使侧链易被氧化 | |
| C. | 若甲苯苯环上的一个氢原子被一个含3个碳原子的烷基取代,所得产物有6种 | |
| D. | 菲的结构简式为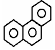 ,它与硝酸反应,可生成3种一硝基取代物 ,它与硝酸反应,可生成3种一硝基取代物 |