题目内容
1.设NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 常温常压下,17g NH3所含的电子数是 10NA | |
| B. | 常温常压下,22.4L氧气含氧原子数为2NA | |
| C. | 0.5 mol/L K2SO4溶液中含有NA个K+离子 | |
| D. | 2.3g金属钠与氧气反应全部生成Na2O时失去的电子数是0.2NA |
分析 A.氨气分子中含有10个电子,根据n=$\frac{m}{M}$计算出氨气的物质的量,再计算出含有电子数;
B.常温常压下,不能使用标况下的气体摩尔体积计算;
C.缺少溶液体积,无法计算溶液中含有钾离子数目;
D.钠为+1价金属,2.3g钠的物质的量为0.1mol,0.1molNa完全反应失去0.1mol电子.
解答 解:A.17g NH3的物质的量为:$\frac{17g}{17g/mol}$=1mol,1mol氨气分子含有10mol电子,含的电子数是10NA,故A正确;
B.常温常压下,不是标况下,不能使用标准状况下的气体摩尔体积计算22.4L氧气的物质的量,故B错误;
C.没有告诉0.5 mol/L K2SO4溶液的体积,无法计算钾离子的物质的量,故C错误;
D.2.3g金属钠的物质的量为:$\frac{2.3g}{23g/mol}$=0.1mol,0.1molNa与氧气反应全部生成Na2O时失去0.1mol电子,失去的电子数是0.1NA,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的计算和判断,题目难度中等,明确标况下气体摩尔体积的使用条件为解答关键,注意掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.下列离子方程式正确的是( )
| A. | 向BaCl2溶液中通入SO2气体:Ba2++SO2+H2O=BaSO3↓+2H+ | |
| B. | FeBr2与Cl2物质的量1:1在溶液中反应:2Fe2++Cl2=2Fe3++2Cl- | |
| C. | 向碳酸钠溶液中加入足量硫酸铝溶液:Al3++3CO32-+3H2O=Al(OH)3↓+3HCO3- | |
| D. | 苯酚钠溶液中通入少量二氧化碳: +CO2+H2O→ +CO2+H2O→ +HCO3- +HCO3- |
9.下列物质与水反应生成强碱的是( )
| A. | Na2O | B. | SO3 | C. | CO2 | D. | NH3 |
16.现有下列4组物质:
A.NaOH、Ca(OH)2、SO2、Fe(OH)3
B.Cl2、C、S、Cu
C.Hg、Cu、Zn、H2
D.H2O、HCl、H2SO4、HNO3
(1)填写下列空白:
(2)4组物质中都属于电解质的是D(填序号).
(3)写出实验室制备Cl2的离子方程式为MnO2+4H++2Cl-(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;.
A.NaOH、Ca(OH)2、SO2、Fe(OH)3
B.Cl2、C、S、Cu
C.Hg、Cu、Zn、H2
D.H2O、HCl、H2SO4、HNO3
(1)填写下列空白:
| A组 | B组 | C组 | D组 | |
| 分类标准 | 碱 | 常温下为固体 | 金属单质 | 酸 |
| 不属于该类别的物质 | SO2 | Cl2 | H2 | H2O |
(3)写出实验室制备Cl2的离子方程式为MnO2+4H++2Cl-(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;.
6.对图两种化合物的结构或性质描述正确的是( )
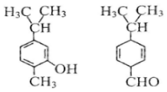

| A. | 不是同分异构体 | |
| B. | 分子中共平面的碳原了数相同 | |
| C. | 含氧官能团的性质不同 | |
| D. | 可用红外光谱区分,但不能用核磁共振氢谱区分 |
13.下列各组物质按酸、混合物、碱顺序排列的是( )
| A. | 空气、硫酸铜、硫酸 | B. | 乙酸、空气、纯碱 | ||
| C. | 氧化铁、胆矾、熟石灰 | D. | 硝酸、蔗糖水、氢氧化铁 |
15.下列溶液一定不会出现沉淀的是( )
| A. | SO2通入CaCl2溶液 | B. | H2S通入CuSO4溶液 | ||
| C. | SO2通入Ca(OH)2溶液 | D. | H2S通入FeSO4溶液 |
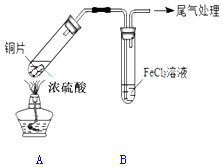 某校化学兴趣小组用如图装置进行SO2与FeCl3溶液的反应
某校化学兴趣小组用如图装置进行SO2与FeCl3溶液的反应