题目内容
实验室中配制1mol/L稀硫酸标准溶液.然后用其滴定某未知浓度的NaOH溶液.下列有关说法中不正确的是( )
| A、实验中所用到的滴定管、容量瓶在使用前均需要查漏 |
| B、若选用100 mL容量瓶配制标准酸溶液,需用密度为1.84g/mL、98%的浓硫酸5.4mL |
| C、中和滴定实验,若滴定前平视读数、滴定结束俯视读数,则导致实验结果偏大 |
| D、酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大 |
考点:溶液的配制,中和滴定
专题:实验评价题
分析:A.根据容量瓶、滴定管的构造及正确使用方法进行分析;
B.根据稀释过程中硫酸的物质的量不变计算出需要浓硫酸的体积;
C.若滴定前平视读数、滴定结束俯视读数,导致读数偏小,读出的标准液体积偏小,测定结果偏低;
D.滴定管没有润洗,会导致标准液被稀释,滴定时消耗的标准液体积偏大,测定结果偏大.
B.根据稀释过程中硫酸的物质的量不变计算出需要浓硫酸的体积;
C.若滴定前平视读数、滴定结束俯视读数,导致读数偏小,读出的标准液体积偏小,测定结果偏低;
D.滴定管没有润洗,会导致标准液被稀释,滴定时消耗的标准液体积偏大,测定结果偏大.
解答:
解:A.容量瓶有瓶塞,配制时需要摇匀,所以使用前必须检查是否漏水;滴定管有旋塞或者橡胶管,使用前必须检查是否漏液,故A正确;
B.配制100mL 1mol/L的溶液,需要硫酸的物质的量为:n=1mol/L×0.1L=0.1mol,稀释过程中硫酸的物质的量不变,则需要浓硫酸的体积为:VmL×1.84g/mL×98%=98g/mol×0.1mol,解得:V≈5.4mL,故B正确;
C.中和滴定实验,若滴定前平视读数、滴定结束俯视读数,导致消耗的标准液读数偏小,测定结果偏低,故C错误;
D.滴定管在盛放酸或者碱溶液时必须润洗,否则会将待装液稀释,如:酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,导致标准液浓度减小,滴定时消耗的标准液体积偏大,测得的NaOH溶液的浓度将偏大,故D正确;
故选C.
B.配制100mL 1mol/L的溶液,需要硫酸的物质的量为:n=1mol/L×0.1L=0.1mol,稀释过程中硫酸的物质的量不变,则需要浓硫酸的体积为:VmL×1.84g/mL×98%=98g/mol×0.1mol,解得:V≈5.4mL,故B正确;
C.中和滴定实验,若滴定前平视读数、滴定结束俯视读数,导致消耗的标准液读数偏小,测定结果偏低,故C错误;
D.滴定管在盛放酸或者碱溶液时必须润洗,否则会将待装液稀释,如:酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,导致标准液浓度减小,滴定时消耗的标准液体积偏大,测得的NaOH溶液的浓度将偏大,故D正确;
故选C.
点评:本题考查了配制一定物质的量浓度的溶液方法、酸碱中和滴定等知识,题目难度中等,注意掌握配制一定物质的量浓度的溶液方法,明确中和滴定操作方法及误差分析的方法.

练习册系列答案
相关题目
下列说法正确的是( )
| A、用0.2mol?L-1 NaOH标准溶液滴定HCl与CH3COOH的混合液(混合液中两种酸的浓度均约为0.1mol?L-1),至中性时,溶液中的酸被完全中和 |
| B、20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
| C、室温下,pH=2 的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) |
| D、0.1 mol?L-1 pH=4的NaHB的溶液中,c(Na+)>c(HB-)>c(H2B)>c(B2-) |
已知反应:X(g)+3Y(g)?2Z(g)为放热反应,一定温度下在密闭容器中进行反应,如图是该反应达平衡及改变条件平衡移动的图象.下列说法正确的是( )


| A、图中的a、b、c、d都是平衡点 |
| B、起始时,加入Y的物质的量为1.3mol |
| C、c点和d点表示正反应速率大于逆反应速率 |
| D、在3MPa和1MPa条件下,反应达平衡时,放出的热量:Q(A)>Q(B) |
常温时的下列溶液,说法正确的是( )
| A、氨水加水稀释,溶液中各离子浓度均减小 |
| B、Na2S和NaHS的混合溶液中:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| C、1.0×10-3mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0 |
| D、在温度不变的条件下向CaSO4饱和溶液中加入Na2SO4溶液,CaSO4将会析出,Ksp也会发生改变 |
质量为ag的铜丝,在空气中灼热变黑,趁热放入下列物质中,铜丝变红,质量大于a g的是( )
| A、盐酸 |
| B、CH3COOH |
| C、C2H5OH |
| D、NaOH |
下列说法错误的是( )
| A、配制FeCl3溶液,为了抑制水解,常加盐酸 |
| B、盐类都能水解 |
| C、盐类水解通常都是吸热的 |
| D、水解达到平衡时的AlCl3稀溶液中,无论再加入饱和AlCl3溶液还是加水或者加热,其水解平衡均向正向移动 |
下列有关金属的工业制法中,错误的是( )
| A、制钠:以海水为原料制得NaCl,再电解熔融NaCl得钠 |
| B、制铁:以焦炭和铁矿石为原料,用CO还原铁矿石得铁 |
| C、制硅:用焦炭还原二氧化硅得硅 |
| D、制镁:以海水为原料,经一系列过程制得氯化镁,用H2还原MgCl2得镁 |
若用乙烯和氯气在适当的条件下反应制取四氯乙烷,乙烯为1mol,反应产物中的有机物只是四氯乙烷,则这一过程中所要经历的反应及耗用氯气的量是( )
| A、取代,4mol Cl2 |
| B、加成,2mol Cl2 |
| C、加成、取代,2mol Cl2 |
| D、加成、取代,3mol Cl2 |
最近研制出一种新材料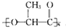 ,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )
,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )
 ,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )
,它能代替聚苯乙烯.它是由乳酸(一种有机酸)缩聚而成,能在乳酸菌的作用下降解而不会污染环境.下列关于聚乳酸的说法正确的是( )| A、聚乳酸是一种纯净物 |
B、聚乳酸的单体是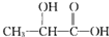 |
| C、聚乳酸是一种羧酸 |
| D、聚乳酸是由其单体通过加聚反应合成的 |