题目内容
15.下列除杂试剂或方法不恰当的是( )| A. | 除去甲烷中的少量乙烯--通过酸性高锰酸钾溶液,洗气 | |
| B. | 除去乙酸乙酯中少量的乙酸--加入饱和碳酸钠溶液,分液 | |
| C. | 除去乙醇中少量的水--加足量生石灰,蒸馏 | |
| D. | 除去溴苯中溶有的溴--加氢氧化钠溶液,分液 |
分析 A.乙烯被氧化生成二氧化碳;
B.乙酸乙酯不溶于饱和碳酸钠,乙酸与碳酸钠溶液反应;
C.水与生石灰反应,可增大沸点差;
D.溴苯不溶于水,溴与氢氧化钠溶液反应.
解答 解:A.乙烯被氧化生成二氧化碳,引入新杂质,应用溴水除杂,故A错误;
B.乙酸乙酯不溶于饱和碳酸钠,乙酸与碳酸钠溶液反应,可用分液的方法分离,故B正确;
C.水与生石灰反应,可增大沸点差,可用蒸馏的方法分离,故C正确;
D.溴苯不溶于水,溴与氢氧化钠溶液反应,然后用分液的方法分离,故D正确.
故选A.
点评 本题考查物质的分离、提纯和除杂等问题,为高频考点,侧重考查学生的分析能力和实验能力,题目难度不大,根据除杂是不能引入新的杂质、不能影响被提纯的物质的性质和量,并且操作简单可行,除杂时要结合物质的物理性质和化学性质进行分离.

练习册系列答案
相关题目
1. 已知拆开1mol氢气中化学键需要吸收436kJ热量,拆开1mol氧气中的化学键需要吸收496kJ的热量,形成1molH-O共价键放出463kJ的热量.反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示.下列说法正确的是( )
已知拆开1mol氢气中化学键需要吸收436kJ热量,拆开1mol氧气中的化学键需要吸收496kJ的热量,形成1molH-O共价键放出463kJ的热量.反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示.下列说法正确的是( )
 已知拆开1mol氢气中化学键需要吸收436kJ热量,拆开1mol氧气中的化学键需要吸收496kJ的热量,形成1molH-O共价键放出463kJ的热量.反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示.下列说法正确的是( )
已知拆开1mol氢气中化学键需要吸收436kJ热量,拆开1mol氧气中的化学键需要吸收496kJ的热量,形成1molH-O共价键放出463kJ的热量.反应2H2(g)+O2(g)═2H2O(g)的能量变化如图所示.下列说法正确的是( )| A. | 2H(g)→H2(g)△H>0 | B. | 图中E1=932kJ | ||
| C. | 图中E2=926 kJ | D. | 2H2(g)+O2(g)═2H2O(g)△H=-484 kJ•mol-1 |
6.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 2.24 L CH4中含碳原子数目是0.1 NA | |
| B. | 0.1 mol•L-1 NaNO3溶液中含Na+数目是0.1 NA | |
| C. | 1 mol Cl2与足量的铁完全反应时得到的电子数目是2 NA | |
| D. | 标准状况下,22.4 L苯中含分子数目是NA |
3.下列装置能将化学能转化为电能的是( )
| A. |  | B. |  | C. |  | D. |  |
10.下列有关金属腐蚀与防护的说法正确的是( )
| A. | 铁上镀锌的保护方法叫牺牲负极的正极保护法 | |
| B. | 相同条件下,轮船在海水中比在淡水中腐蚀慢 | |
| C. | 钢铁在潮湿的空气中会发生吸氧腐蚀,负极反应为Fe-3e-=Fe3+ | |
| D. | 水库里钢闸门与电源负极相连的方法叫做外加电流的阴极保护法 |
7.下列说法不正确的是( )
| A. | 环戊二烯(  )分子中所有碳原子共平面 )分子中所有碳原子共平面 | |
| B. | 正丁烷与异丁烷互为同分异构体的依据是它们的分子式相同,但分子内碳原子的连接方式不同 | |
| C. | 七叶内酯( )和东莨菪内酯( )和东莨菪内酯( )都是某些中草药中的成分,它们具有相同的官能团,互为同系物 )都是某些中草药中的成分,它们具有相同的官能团,互为同系物 | |
| D. | 有机物(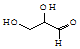 )不能与氢氧化钠发生中和反应,但能发生取代反应 )不能与氢氧化钠发生中和反应,但能发生取代反应 |
4.下列物质的熔、沸点高低顺序正确的是( )
| A. | 金刚石>晶体硅>二氧化硅>碳化硅 | B. | CI4>CBr4>CCl4>CF4 | ||
| C. | NH3>H2O>N2>CO | D. | HF>HCl>HBr>HI |
8.下列实验中,反应速率增大是由催化剂引起的是( )
| A. | 双氧水中加入少量MnO2,即可迅速放出气体 | |
| B. | 锌与稀硫酸反应中加入少量CuSO4溶液,反应放出H2的速率加快 | |
| C. | 固态FeCl3和固体NaOH混合后,加入水能迅速产生沉淀 | |
| D. | 在炭粉中加入KClO3,点燃时燃烧更为剧烈 |